М.Ю. Соколов, А.А. Лазаренко
Сложно переоценить проблему атеросклероза в современной кардиологии. Несмотря на появление в клинической медицине новых технологий лечения и диагностики сосудистых проявлений атеросклероза, остается много непонятного и непредсказуемого в развитии этого патологического состояния. Даже в самом названии есть некоторое противоречие: атеросклероз — греч. athera (кашица) и sclerosis (затвердевание), то есть одновременно и затвердевание, и размягчение, в клинической практике это выглядит как стабильное и нестабильное проявление симптомов. Заболевание может начинаться уже в молодом возрасте (как правило, бессимптомно, в виде незначительных морфологических изменений) и с годами несет в себе опасность атеротромбоза и его последствий. В основе развития атеросклероза лежит последовательное взаимодействие многих патогенетических факторов, ведущее в конечном счете к образованию фиброзной бляшки (неосложненной и осложненной).
Сам патогенез достаточно сложен и недостаточно изучен. В результате повреждения эндотелия формируется эндотелиальная дисфункция, проявляющаяся снижением продукции вазодилатирующих факторов (простациклин, окись азота и др.) и увеличением образования вазоконстрикторных веществ. Моноциты, проникшие в интиму, трансформируются в макрофаги, которые поглощают модифицированные липопротеины низкой и очень низкой плотности и накапливают свободный и эстерифицированный холестерин. Перегруженные липидами макрофаги превращаются в пенистые клетки, гладкомышечные клетки приобретают способность самим продуцировать элементы соединительной ткани (коллаген, эластин и гликозаминогликаны), которые в дальнейшем становятся фиброзным каркасом атеросклеротической бляшки (АБ). Со временем пенистые клетки подвергаются апоптозу, в результате чего липиды попадают во внеклеточное пространство.
Одним из основных факторов, вызывающих острое коронарное событие, считают тромбоз. Важным в этом патологическом процессе является разрыв или эрозия АБ.
Также определены морфологические особенности АБ высокого риска, склонных к разрыву:
- большой объем АБ;
- позитивное ремоделирование коронарной артерии, приводящее к ее «разбуханию» в зоне локализации атеромы;
- большое липидное ядро (более 40 % объема АБ), содержащее эфиры и кристаллы холестерина, окисленные липиды;
- инфильтрация фиброзной покрышки и адвентиции клетками воспаления (в основном макрофагами, а также активированными Т-клетками и тучными клетками);
- тонкая фиброзная покрышка, менее 65 мкм, обедненная коллагеном и гладкомышечными клетками;
- повышенная неоваскуляризация адвентиции и интимы.
После внедрения в клиническую практику внутрисосудистых технологий диагностики (оптическая когерентная томография (ОКТ), внутрисосудистое ультразвуковое исследование) появилась возможность выявлять осложненные АБ и те поражения, которые могут вызвать тромботические осложнения.
ОКТ – это высокоточный метод внутрисосудистой визуализации, который использует лазерное излучение с длиной волны 1300 нм для получения информации о строении сосудистой стенки и структур, расположенных в просвете коронарной артерии (внутрисосудистые, пристеночные тромбы, бранши стента и т. д.). Впервые метод был описан в 1991 г. D. Huang и соавторами [1] и использован для получения изображения сетчатки глаза. Удобство световой волны в офтальмологии объяснимо, свет – это естественная среда функции органа зрения. С момента опубликования D. Huang своей работы началась эра использования ОКТ в офтальмологии [2]. Затем после некоторой модификации методика нашла себя в гастроэнтерологии [3], дерматологии [4–8], стоматологии [9] и, наконец, во внутрисосудистой визуализации в кардиологии [10–12]. Длина волны для внутрисосудистых исследований выбрана близкой по спектру к инфракрасному излучению для получения оптимальной глубины проникновения и разрешающей способности [11]. Изображения строятся на основании информации об интенсивности отраженного света и времени, через которое принимается отраженный сигнал. Лазерное излучение от источника подается через оптоволокно на верхушку специального катетера, введенного в коронарную артерию, на конце которого находится система отражателей, направляющих его в одну точку. Получение изображения достигается путем вращения системы вокруг своей оси и одновременно поступательного движения от дистального конца к проксимальному. В результате происходит спиралеобразное сканирование поверхности сосудистого сегмента.
Необходимо отметить определенные достоинства и недостатки методики ОКТ при сравнении с уже хорошо известным методом – внутрисосудистым ультразвуковым исследованием (intravascular ultrasound, IVUS). Разрешающая способность исследования с помощью световой волны L равна r2/λ, где λ – длина волны, r – расстояние [14]. Учитывая, что длина ультразвуковой волны примерно в 1000 раз больше, чем длина инфракрасной волны, получаем, что теоретически разрешающая способность внутрисосудистого ультразвукового исследования в 1000 раз меньше, чем у метода ОКТ. В реальности эта разница меньше, поскольку разрешающая способность метода ОКТ на практике ограничена угловой скоростью вращения датчика, то есть наше устройство успевает просветить все необходимое гораздо быстрее, чем мы можем «считать» эту информацию датчиком, который вынужден вращаться для получения картинки, похожей на сосуд. Именно поэтому, с точки зрения физики, разрешающая способность методики с использованием световой волны на практике примерно в 100 раз меньше, чем в теории [14]. При прямом сравнении разрешающая способность ОКТ по сравнению с внутрисосудистым ультразвуковым исследованием, несмотря на физические ограничения, выше около 13 раз. Однако у ультразвука есть свои преимущества перед инфракрасным излучением, связанные, в первую очередь, со свойствами света. Благодаря большей длине волны проникающая способность ультразвука выше, чем у света. Поэтому ОКТ дает лучшее изображение поверхностных сред, а ультразвук – глубоких. Это, например, ограничивает диагностическую ценность метода ОКТ в оценке степени вовлеченности в атеросклеротический процесс ствола левой коронарной артерии (ЛКА) и венозных шунтов [15]. Важнейшей технической особенностью ОКТ является тот факт, что кровь выступает серьезной помехой в проведении исследования. Кровь плохо пропускает свет (мутная среда), что делает практически невозможным проводить исследования через поток крови. Именно с этой целью система сканирования ОКТ настроена на момент, когда вокруг датчика среда становится прозрачной, то есть кровь «исчезает». Это момент прохождения через сосуд контрастного вещества. Другими словами, после установки датчика в нужном месте артерии исследователь должен ввести контраст (то есть сделать коронарографию), в данном случае для того, чтобы на несколько секунд «избавиться» от крови. Датчику необходимо 2–4 с для того, чтобы просканировать 40–50 мм сосуда. Для пациента и исследователя этот момент выглядит как проведение обычной коронарной ангиографии. В некоторых случаях, когда исследователю не удается «избавиться» от крови полностью, то на записи после сканирования можно заметить соответствующие артефакты, напоминающие завихрения мутной жидкости в прозрачной среде.
Уникальным клиническим преимуществом ОКТ является возможность на основании анализа полученных изображений построения поперечных срезов артерии с высокой частотой и высоким разрешением. Первые исследования на эту тему были опубликованы в 1996 г. [16]. Дальнейшие исследования показали высокую специфичность метода ОКТ для оценки строения АБ. Так, в 2002 г. было опубликовано исследование, в котором сравнивали патологоанатомические гистологические заключения с заключениями виртуальной гистологии ОКТ. Было проведено сравнение 357 трупных атеросклеротических сегментов. АБ были разделены на фиброзные, фиброзно-кальциевые и липидные. Специфичность методики в идентификации кальцифицированных АБ составила 97 %, липидных – 92 %, фиброзных – 79 % [17]. Как известно, толщина «фиброзного колпачка» АБ является важным прогностическим фактором ее разрыва. В 95 % случаев разрывов АБ толщина ее покрышки меньше 65 нм [18]. Два исследования доказали высокую специфичность метода ОКТ в измерении толщины фиброзной покрышки АБ [19, 12]. Также ОКТ может дифференцировать белые и красные тромбы [20, 21], скопление макрофагов и пенистых клеток [22, 23].
Клинический случай
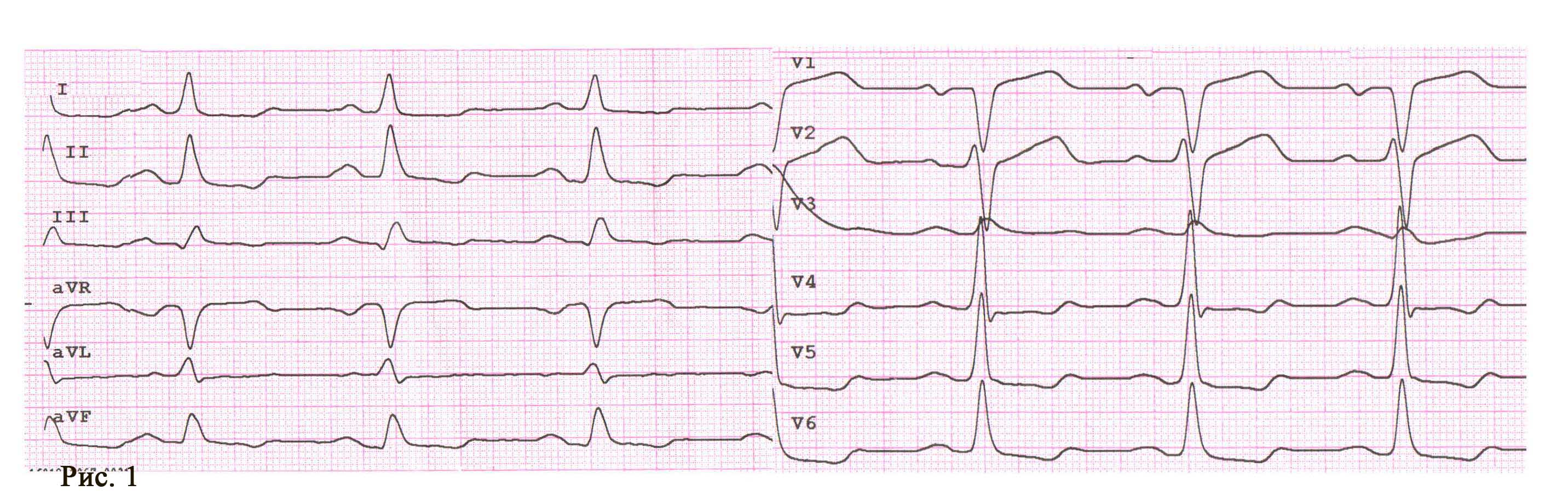
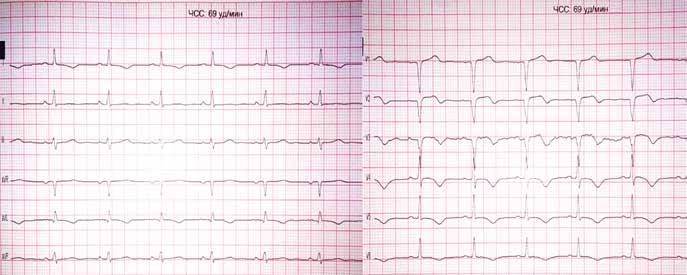
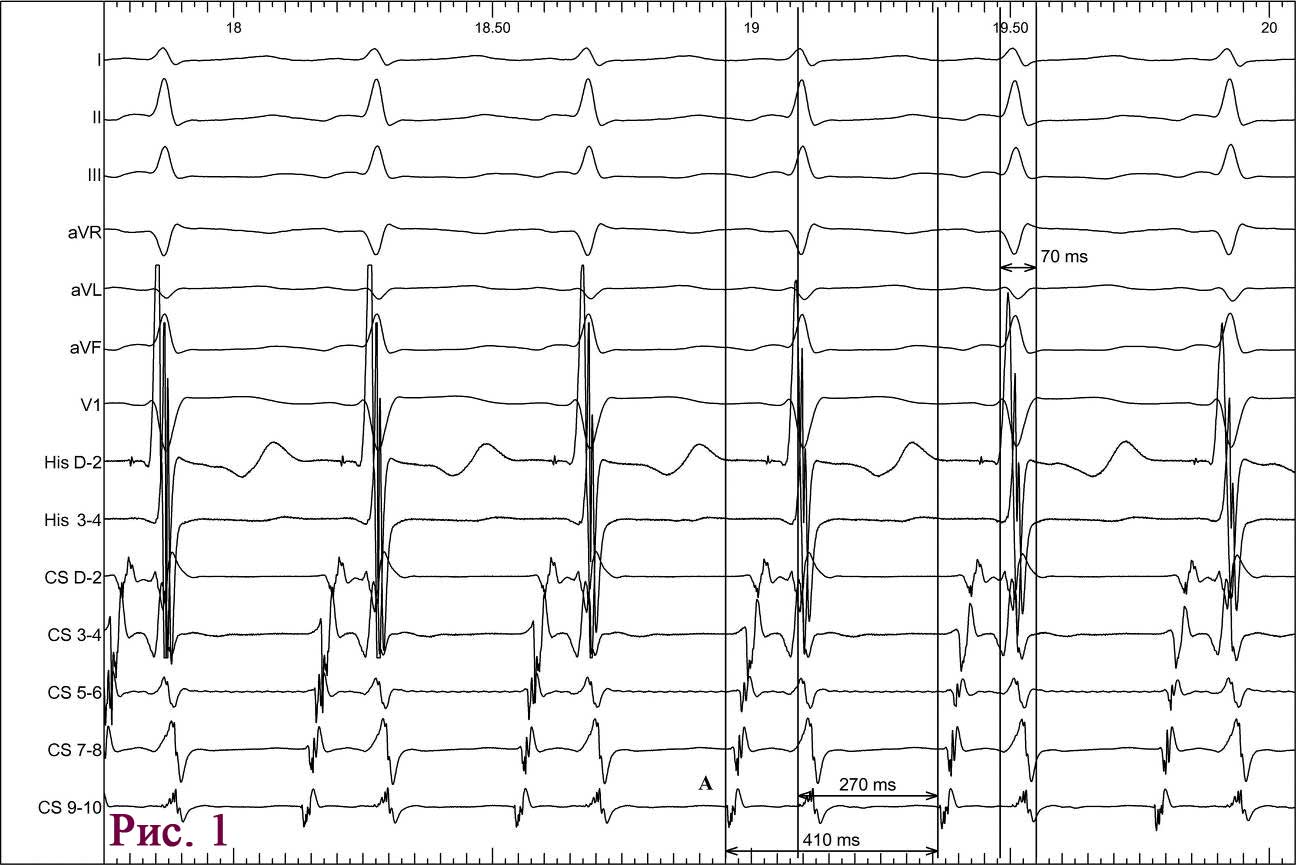
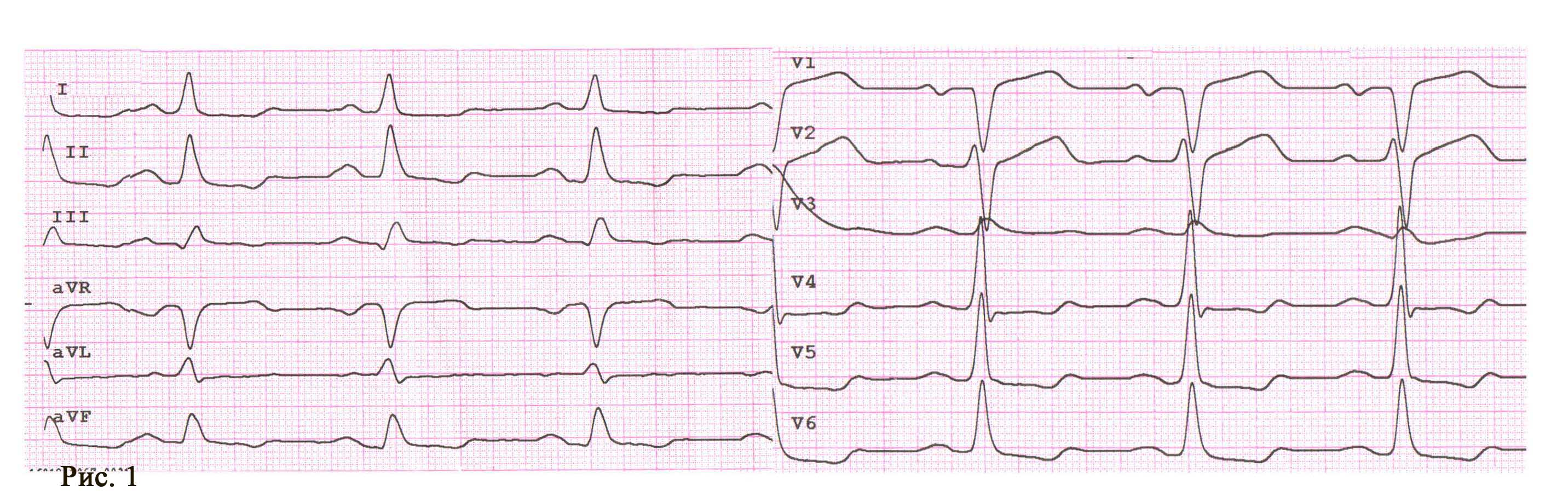
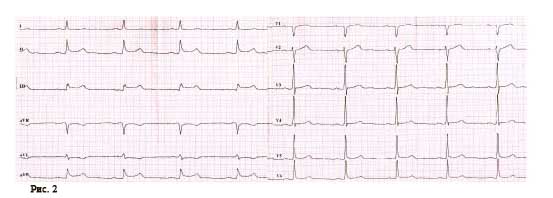
Пациент Ж., 67 лет, предъявлял жалобы на интенсивный приступ загрудинных болей в покое, обратился в службу экстренной медицинской помощи и после короткой диагностики (сбор анамнеза и ЭКГ) был доставлен в приемный покой ЦРБ. При проведении повторного ЭКГ-исследования в приемном отделении был направлен для продолжения лечения по месту жительства, в связи с отсутствием показаний к ургентной коронарографии (рис. 1).
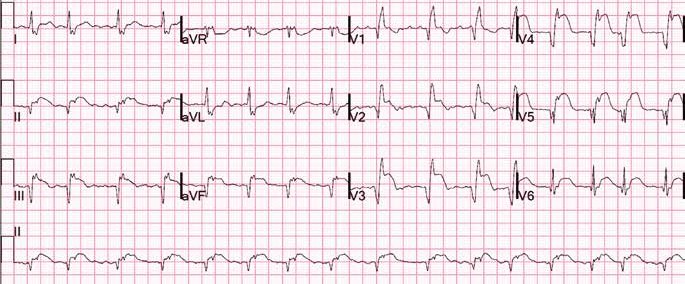
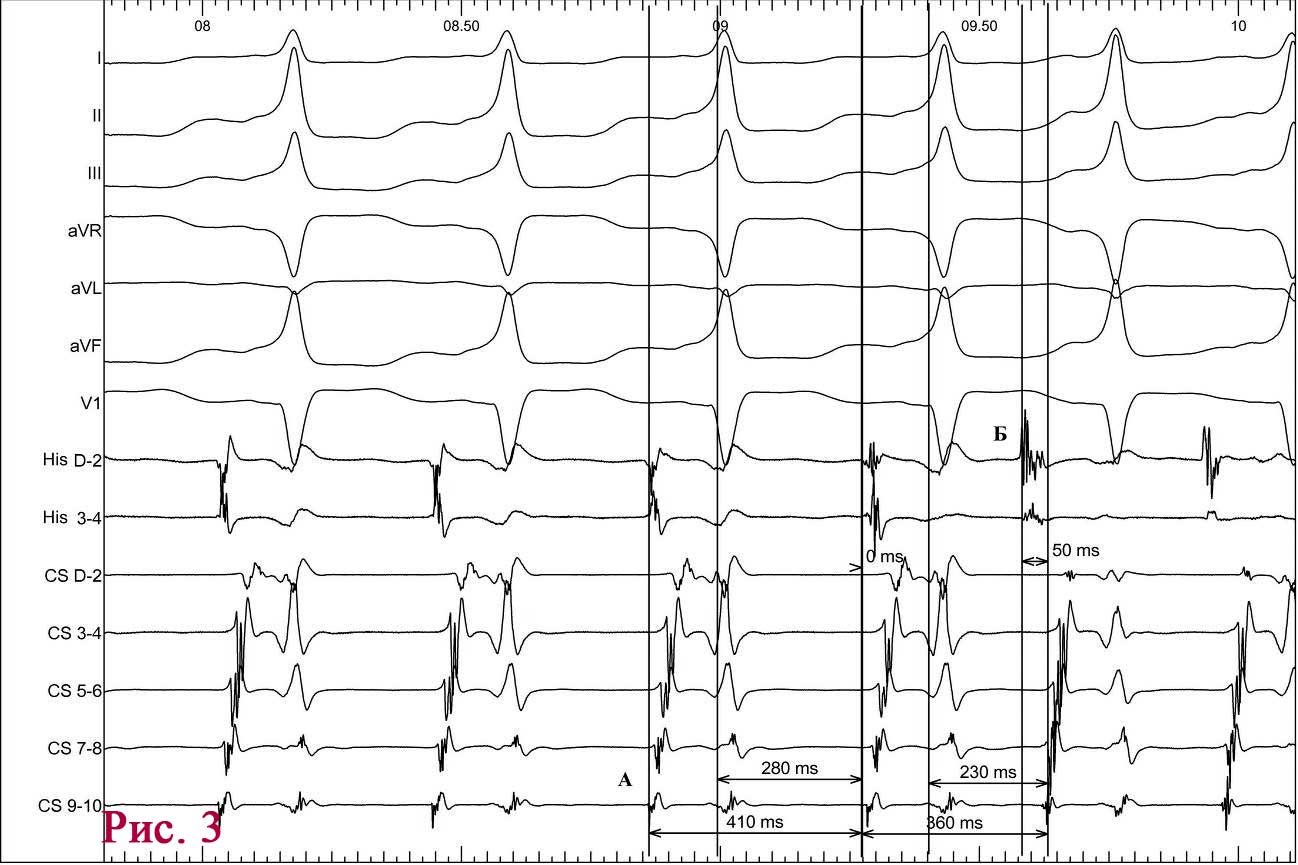
В кардиологическом отделении в больнице по месту жительства на следующее утро после госпитализации у пациента возобновляется повторный приступ стенокардии с более серьезными ишемическими изменениями (рис. 2).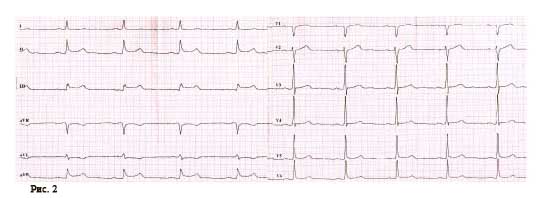
После согласования пациент Ж. переводится в отделение интервенционной кардиологии и реперфузионной терапии ННЦ «Институт кардиологии имени акад. Н.Д. Стражеско» НАМН Украины.
Пациент поступил в отделение 25.10.2018 г. в стабильном состоянии с диагнозом: ИБС. Острый инфаркт миокарда левого желудочка без зубца Q от 23.10.2018 г. с жалобами на загрудинные давящие боли при физической нагрузке (100 м). Данные анализов: гемоглобин – 152 г/л; лейкоциты – 7,5 · 109 г/л; эритроциты – 4,9 · 1012; тромбоциты – 281 · 109 г/л, общий холестерин – 6,4 ммоль/л, глюкоза крови – 6,3 ммоль/л, креатинин –131 мкмоль/л, билирубин – 17 мкмоль/л, кардиоспецифические ферменты отрицательны.
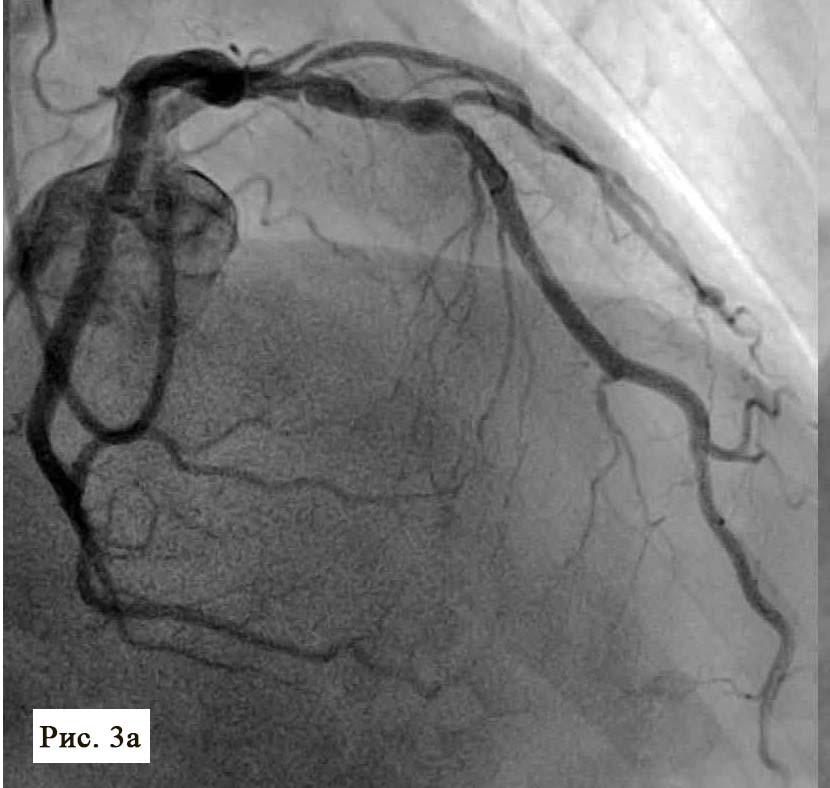
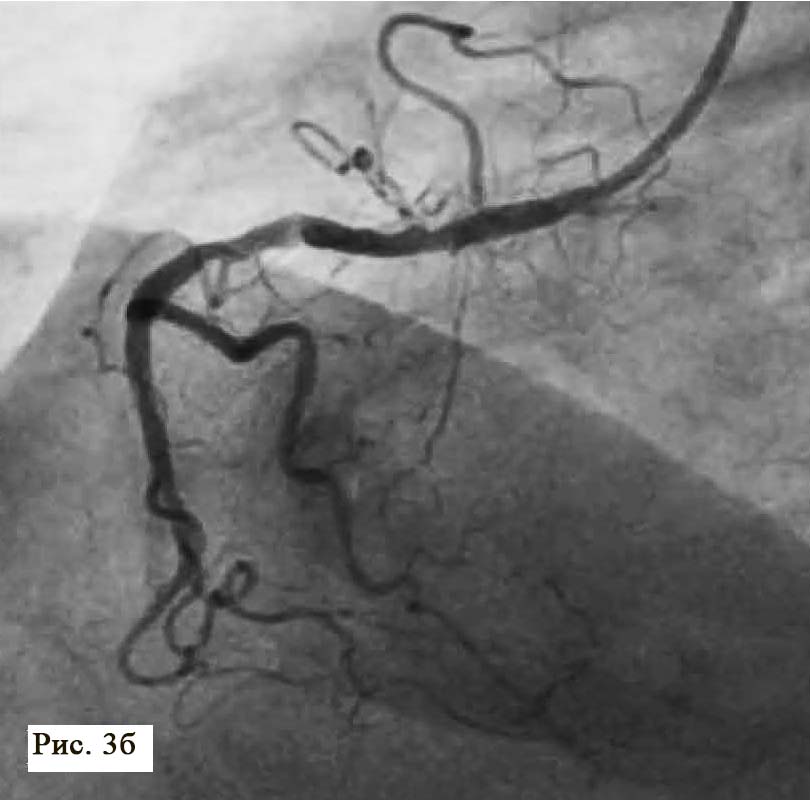
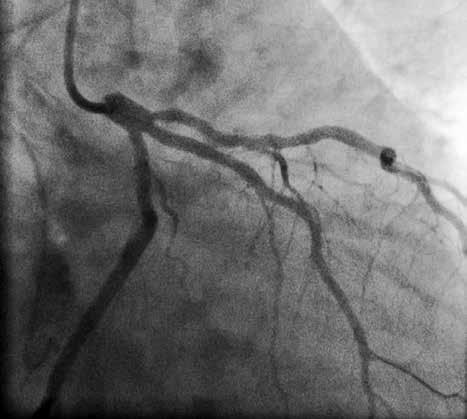
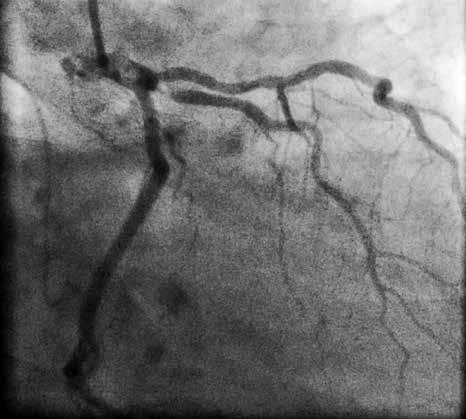
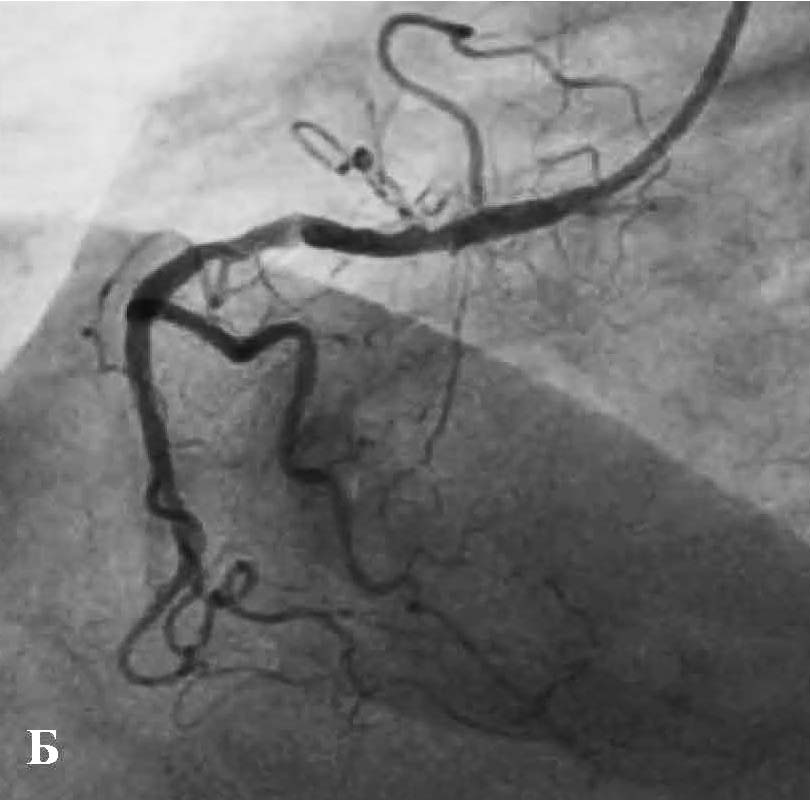
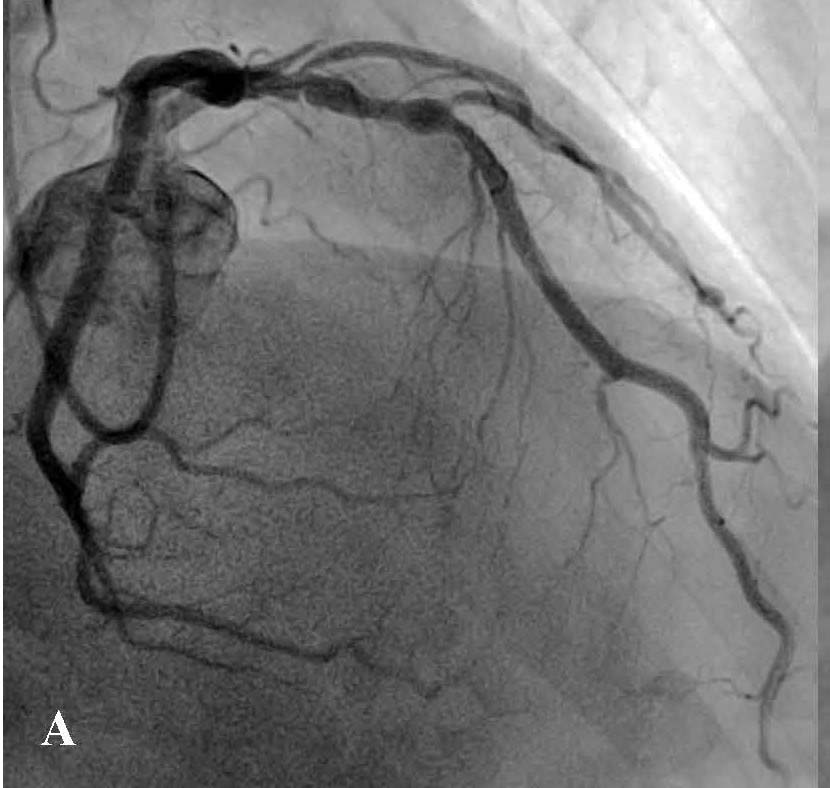
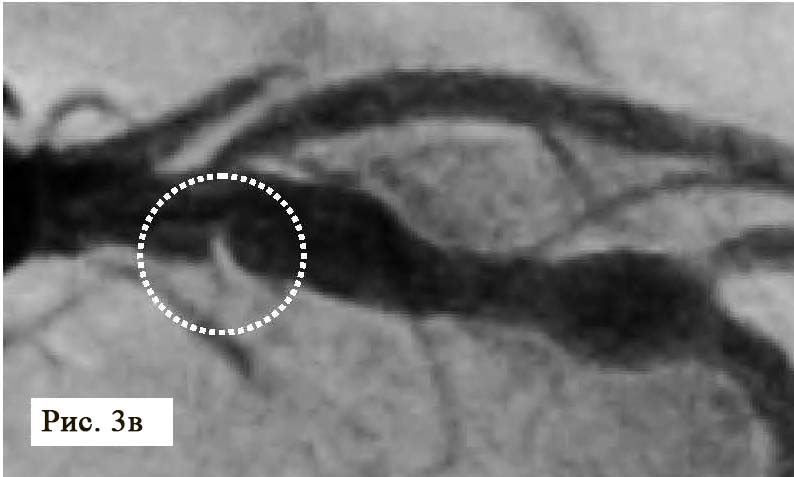 Пациент поступил в стационар в стабильном состоянии. Однако с учетом данных анамнеза и ЭКГ-мониторинга были установлены показания для проведения коронарографии, с целью определить причину клинических проявлений и выбрать тактику лечения. Во время проведения коронарографии обнаружено: на фоне отсутствия признаков атеросклероза в правой коронарной артерии сосуд представлен малой рецессивной артерией, которая не участвовала в кровоснабжении левого желудочка (рис. 3), в ЛКА обнаружены признаки атеросклеротического поражения проксимального и среднего сегментов передней межжелудочковой ветви (ПМЖВ) ЛКА. Кроме внешне стабильных поражений, была выявлена АБ со сложной морфологией и с признаками разрушения и, возможно, пристеночного тромбообразования (см. рис. 3). С целью выяснения сложности поражения и определения прогноза развития атеросклероза была проведена ОКТ.
Пациент поступил в стационар в стабильном состоянии. Однако с учетом данных анамнеза и ЭКГ-мониторинга были установлены показания для проведения коронарографии, с целью определить причину клинических проявлений и выбрать тактику лечения. Во время проведения коронарографии обнаружено: на фоне отсутствия признаков атеросклероза в правой коронарной артерии сосуд представлен малой рецессивной артерией, которая не участвовала в кровоснабжении левого желудочка (рис. 3), в ЛКА обнаружены признаки атеросклеротического поражения проксимального и среднего сегментов передней межжелудочковой ветви (ПМЖВ) ЛКА. Кроме внешне стабильных поражений, была выявлена АБ со сложной морфологией и с признаками разрушения и, возможно, пристеночного тромбообразования (см. рис. 3). С целью выяснения сложности поражения и определения прогноза развития атеросклероза была проведена ОКТ.
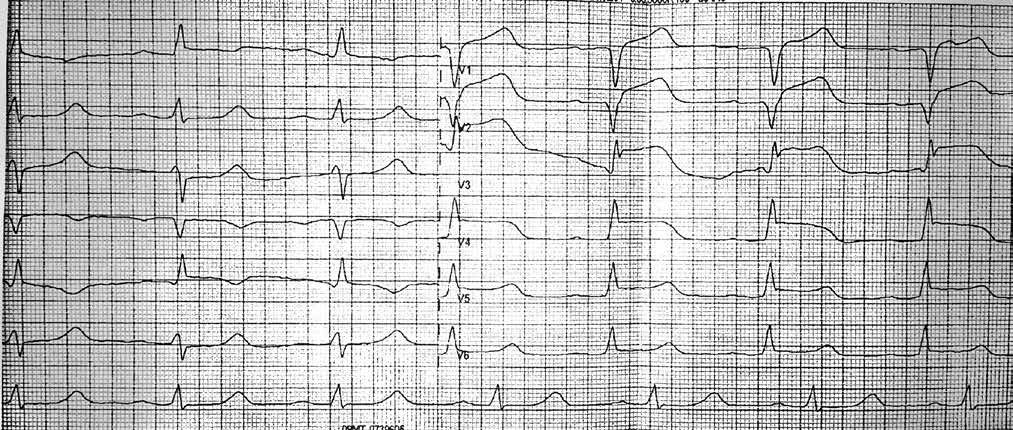
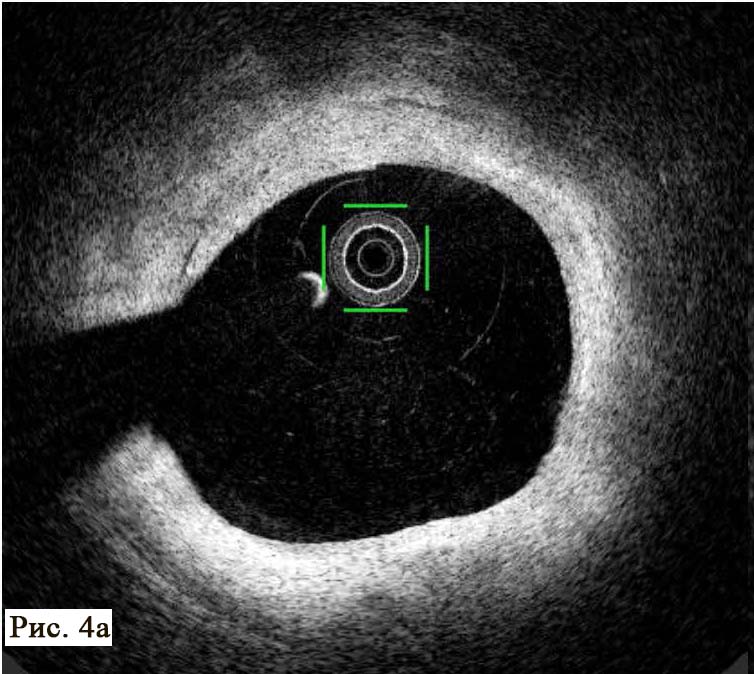
При анализе результатов ОКТ были диагностированы как непораженные (рис. 4 А, В), так и патологически измененные сегменты коронарной артерии (рис. 4 Б, В).
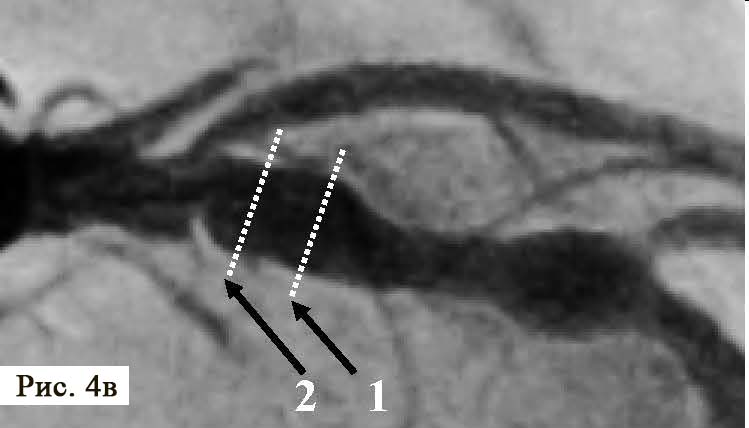
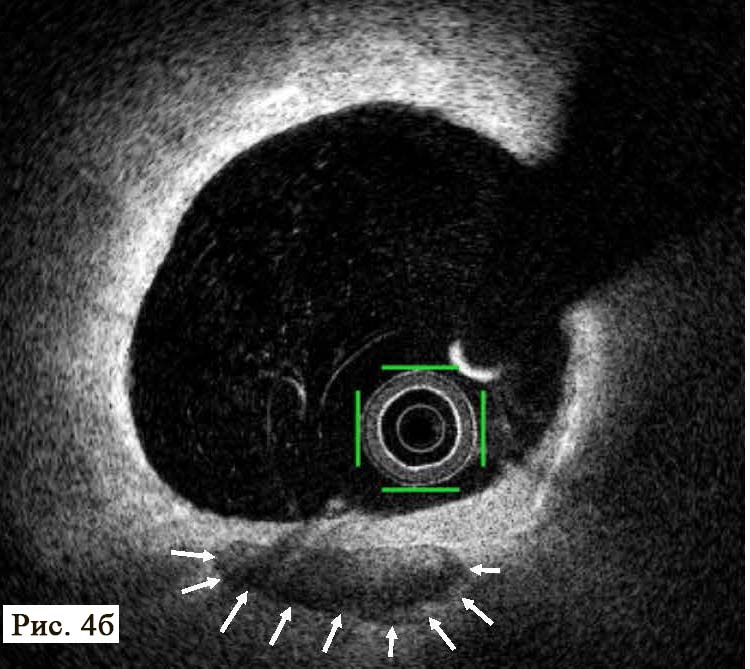
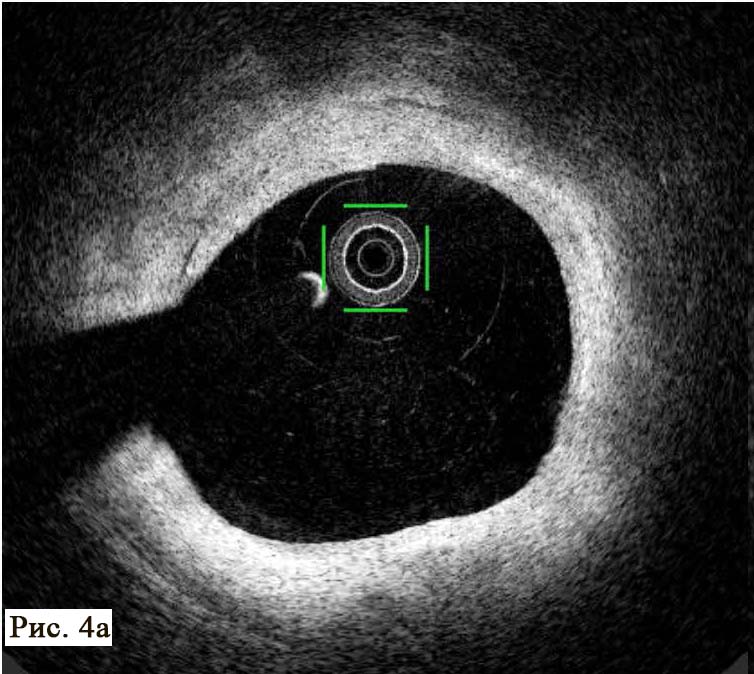
Методика позволяет в деталях увидеть структуру стенки артерии, место и угол отхождения боковых сосудов, степень поражения и конфигурацию устья боковых ветвей, что крайне важно для выбора тактики лечения и контроля эффективной перкутанной терапии пациентов в момент стентирования. В патологически измененной части артерии был обнаружен пораженный сегмент ПМЖВ ЛКА, который имеет небольшие АБ с признаками уязвимых (образования наполнены некротическим детритом, приближающимся по плотности к мази/жидкости) с различной степенью истончения фиброзных колпачков (см. рис. 4 Б, В, рис. 5 А, Б).
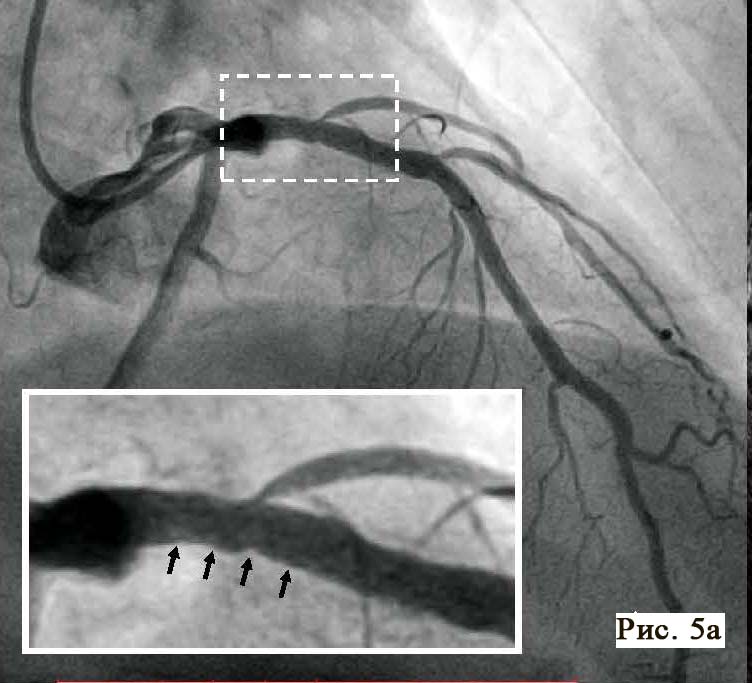
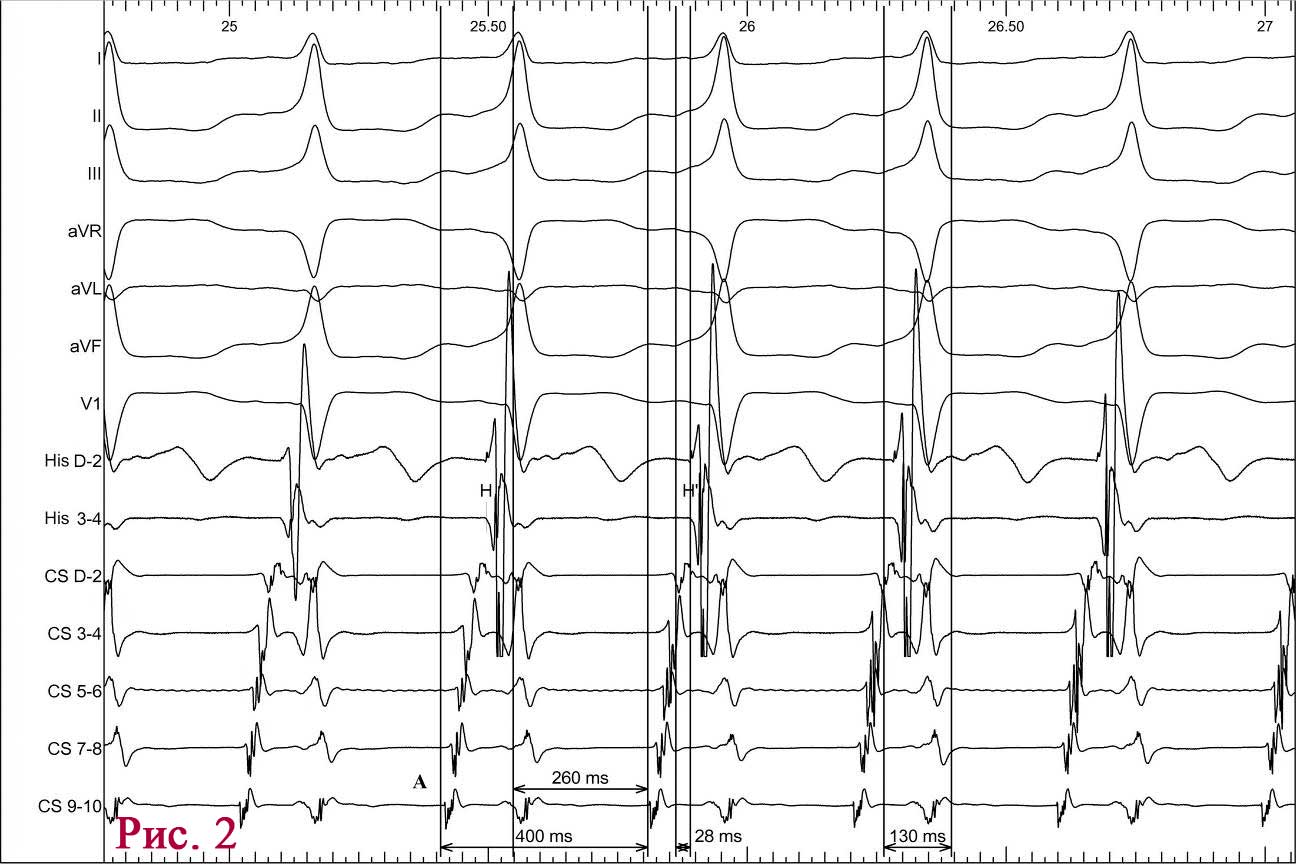
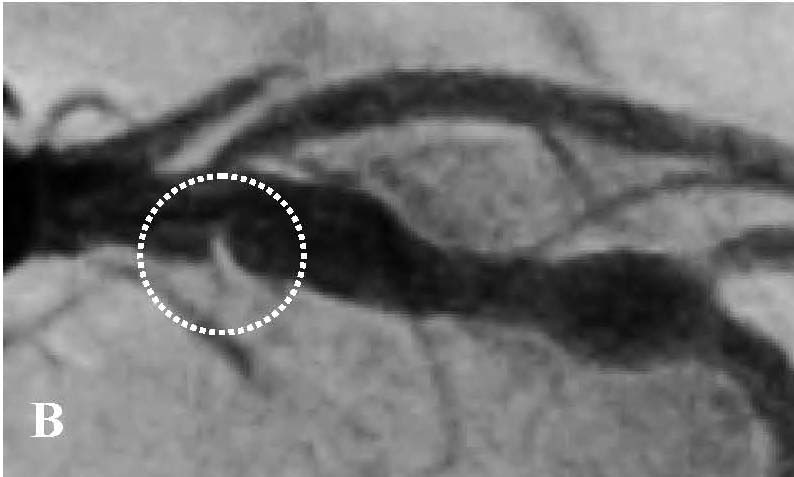
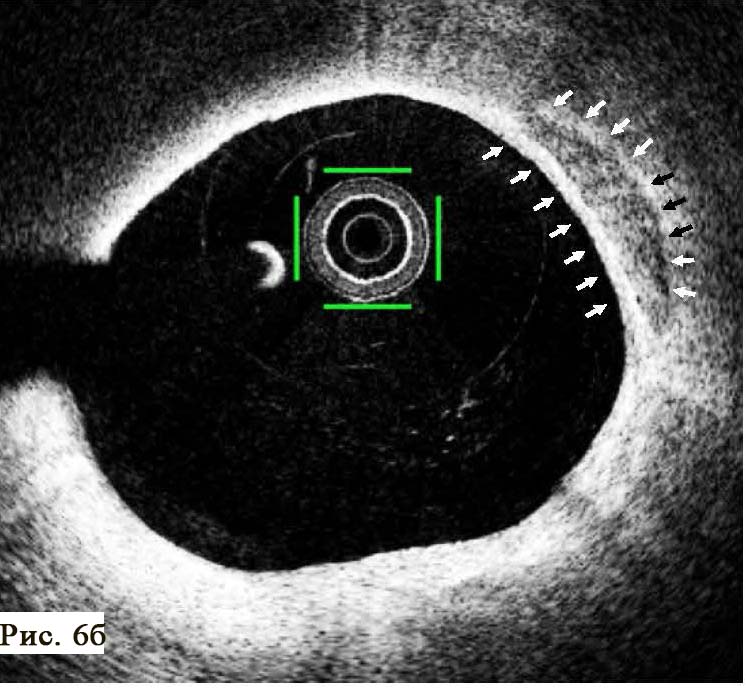
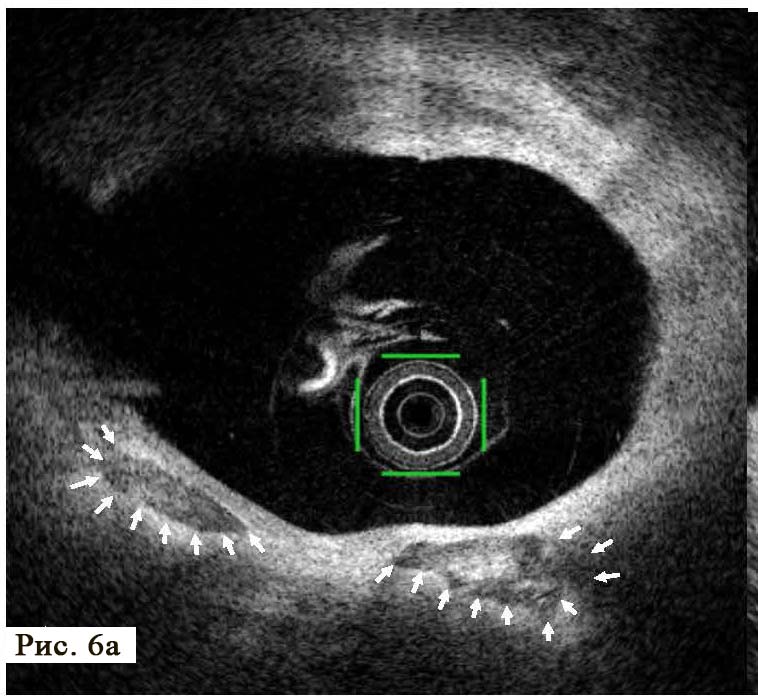
Во время ОКТ обнаружен фрагмент АБ с явными признаками разрушения (без пристеночного тромбообразования, рис. 6). На рисунке можно отчетливо различить «вскрывшуюся» покрышку АБ с флотирующим фрагментом, который при ангиографии совершает еле заметные движения в систолу и диастолу. Именно в этом месте АБ была разрушена, что, вероятно, явилось причиной выхода в просвет коронарной артерии патологического некротического детрита из полости АБ. Этот факт, бесспорно, способствовал образованию внутрипросветного тромба, который и вызвал острую ишемию на ЭКГ. Кратковременная элевация сегмента ST зафиксирована на стандартном ЭКГ-исследовании в области задней стенки левого желудочка (см. рис. 2). Учитывая тот факт, что у представленного пациента на коронарографии (см. рис. 3 А, Б) обнаружен крайне левый тип кровоснабжения задней стенки левого желудочка, то очевидно, что за кровоснабжение задней стенки левого желудочка отвечает левая ЛКА, а в данном случае ПМЖВ ЛКА. Поскольку разрушенная АБ небольшого размера (до момента разрушения, она вообще не выступала в просвет сосуда), следовательно, не могла способствовать росту и «укреплению» тромба в месте его разрушения. Другими словами, рост внутрипросветного тромба был остановлен достаточно активным ламинарным током крови, который не испытывал в этом фрагменте сосуда существенных препятствий (АБ малого размера). После появления тромба на ЭКГ возникли признаки острой ишемии, но через 30–40 мин элевация сегмента ST уже не определялась, что свидетельствует о спонтанном разрушении и лизировании тромба в зоне АБ. Эта предположительная цепочка последовательных событий весьма вероятна при анализе данных ОКТ.
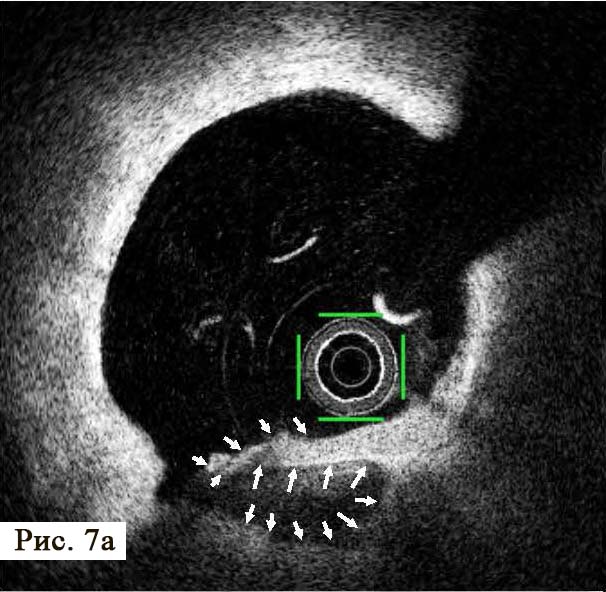
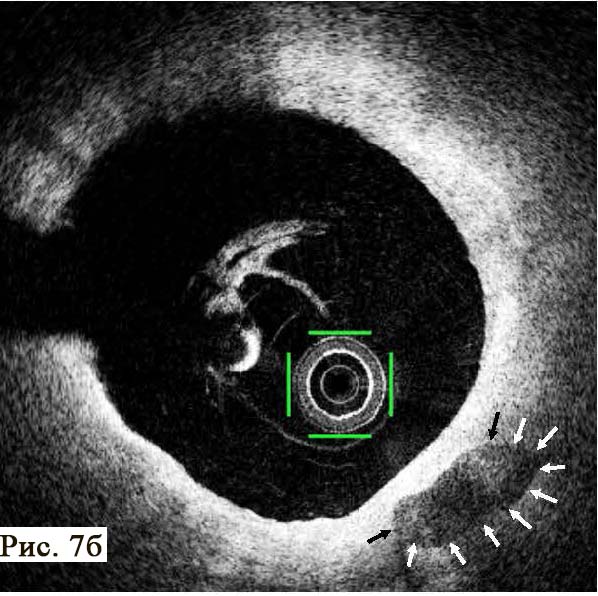
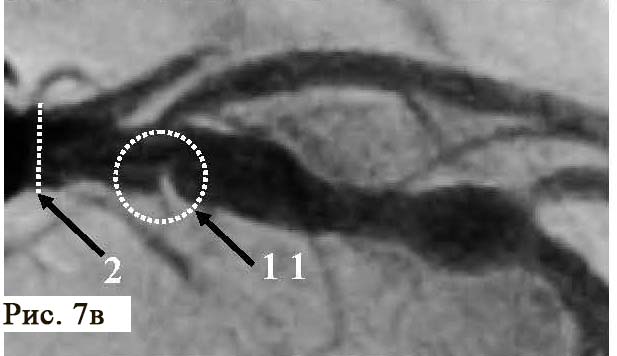
Анализ пораженного сегмента коронарной артерии при помощи ОКТ, мы обнаружи ли несколько неразрушенных АБ, заполненных некротическим детритом и способных к дальнейшему разрушению с течением времени (рис. 7). Эти патологические структуры имели «фиброзные колпачки» различной толщины. Особенностью этой стадии атеросклеротического процесса является практическое отсутствие ангиографически видимых изменений в просвете коронарной артерии, при проведении ангиографии. Это существенно затрудняет диагностику уязвимых АБ, которые мы можем наблюдать при проведении внутрисосудистых исследований, в частности, при проведении ОКТ. Безусловно, отсутствие препятствий коронарному кровотоку не вызывало у пациента стенокардии напряжения, не определялось при тестах с дозированной физической нагрузкой. Но при этом подобные АБ могут вызвать острый коронарный синдром с различными клиническими проявлениями и прогнозами.
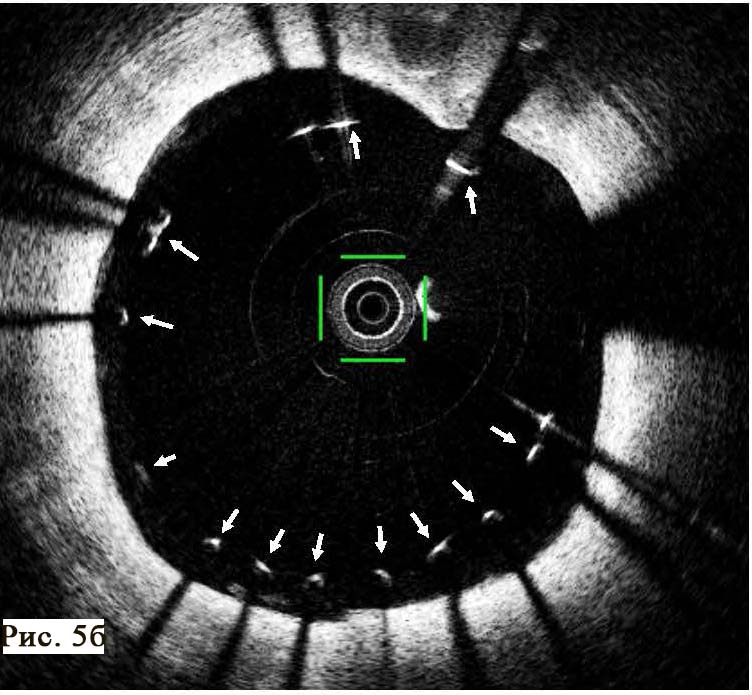
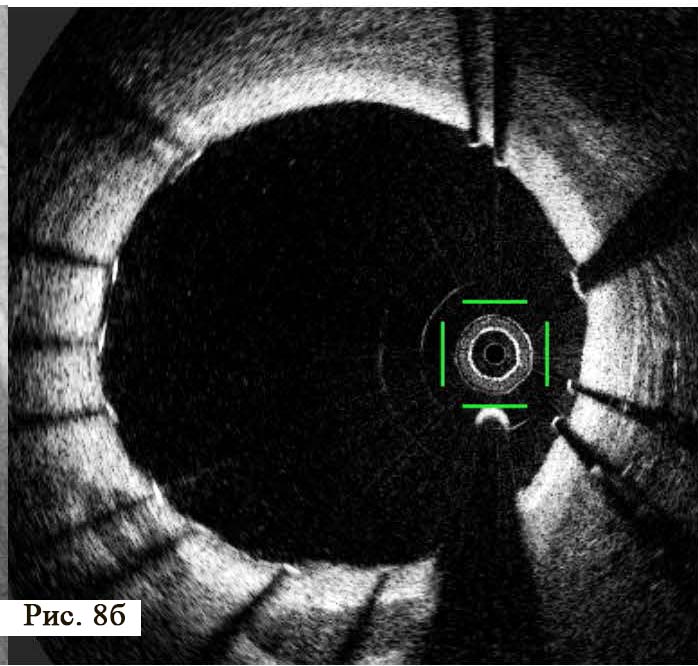
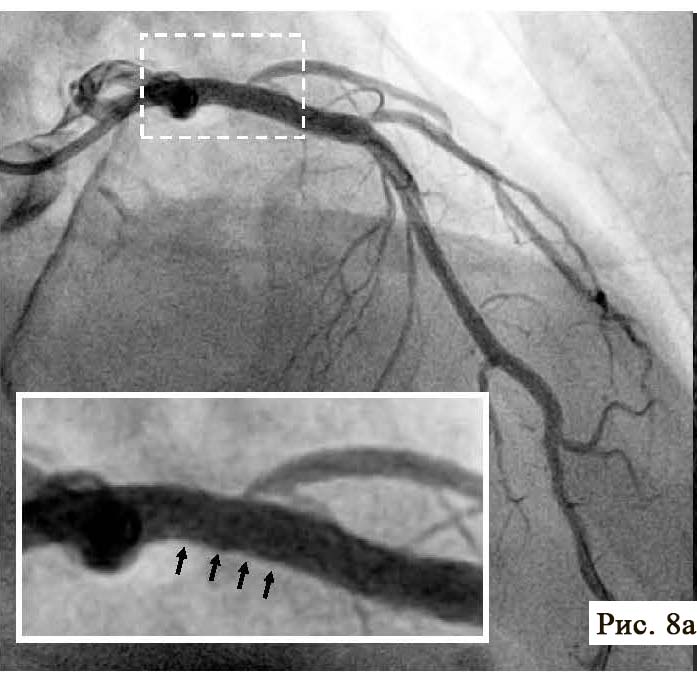
Следующей важнейшей задачей ОКТ является отчетливая визуализация степени адекватности имплантации внутрикоронарного стента. Особенно это касается стентов с лекарственным покрытием, так как процесс выделения с поверхности стента лекарственного препарата требует плотного физического контакта с поверхностью стенки сосуда. В обратном случае, цитостатический препарат будет смываться с поверхности стента и не будет оказывать антипролиферативного действия. Кроме того, неполное прилегание стента к стенке сосуда образует специфические турбулентности крови и способствует образованию тромба на поверхности стента. Неполное прилегание стента к стенке артерии называется malposition (то есть неправильное положение). Своевременное выявление «неправильного положения» стента и адекватное его расправление в просвете коронарной артерии может полностью устранить негативное влияние эндопротеза на прогноз лечения. В нашем клиническом случае ангиографическая картина установленного стента не смогла обеспечить полного контроля за эффективной имплантацией (см. рис. 5 А). На ангиограмме после стентирования заметны только крайне незначительные неровности поверхности артерии, сложные для интерпретации. В то же время, проведение ОКТ помогло своевременно обнаружить фрагменты стента, которые не были эффективно прижаты к стенке артерии (см. рис. 5 Б). Как правило, повторное использование баллона большего размера способно восстановить адекватный просвет артерии и обеспечить плотное прилегание стента к поверхности сосуда (рис. 8).
Кроме изучения прижизненной анатомии коронарного русла у пациентов с патологической морфологией различной степени и определения (контроля) адекватности имплантации стентов с лекарственным покрытием, ОКТ может определять различные степени диссекций артерий во время баллонных дилатаций и установки стентов. В большинстве случаев малые диссекции довольно часто возникают во время стентирований в краевых зонах установленных стентов (рис. 9) и редко приводят к тромботическим осложнениям, а также к необходимости вмешательства с целью лечения или предотвращения сосудистых осложнений вмешательства. Однако информация, которую мы получаем с помощью внутрисосудистой визуализации, может изменить (индивидуализировать) программу антитромбоцитарной терапии и снизить уровень возможных тромбозов в период госпитализации, а в некоторых случаях превентивно использовать дополнительный стент с целью предотвращения осложнений.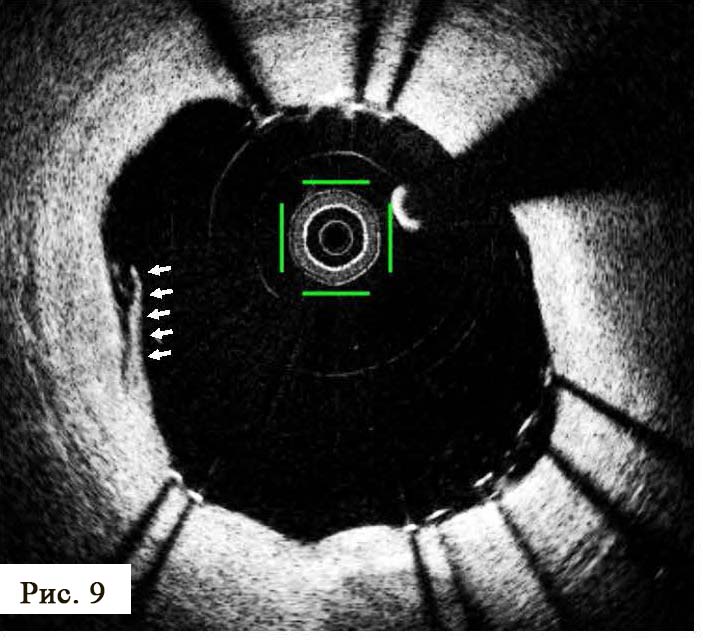
Выводы
Оптическая когерентная томография у пациентов с поражением коронарных артерий является дополнительным внутрисосудистым методом диагностики у плановых и ургентных пациентов с коронарным атеросклерозом и другими патоморфологическими изменениями артерий сердца. Отличительными особенностями методики можно считать высокую разрешающую способность получаемого изображения, возможность изучения субклинических проявлений коронарного атеросклероза (не видимые на коронарографии атеросклеротические бляшки и их морфологическое состояние), максимально точный анализ адекватности имплантации стентов, особенно в сложных морфологических ситуациях.