А.Н. Пархоменко, Я.М. Лутай, О.И. Иркин, С.П. Кушнир
Пример коррекции антиагрегантной терапии после развития фибрилляции предсердий
Введение
Фибрилляция предсердий (ФП), по данным разных исследований, осложняет от 6 до 28 % инфарктов миокарда (ИМ), часто ассоциируется с тяжелым поражением левого желудочка и развитием сердечной недостаточности [1, 2]. Пароксизмы аритмии могут начаться в любой момент, длиться от нескольких минут до часов и даже суток, как правило, повторяются. ФП не несет прямой угрозы жизни, как желудочковые нарушения ритма, и легко переносится у пациентов со стабильной гемодинамикой. Однако согласно данным двух систематических обзоров [1, 3] развитие ФП у пациентов с острым ИМ (ОИМ) является предиктором смерти от всех причин, независимо от тактики лечения и частоты рецидивирования. Кроме того, хорошо известно, что ФП – это самостоятельный фактор риска кардиоэмболических инсультов и нецеребральных эмболий, а это напрямую влияет на прогноз пациентов. Появление ФП у пациента с острым коронарным синдромом (ОКС) всегда требует переоценки рисков и коррекции антикоагулянтной и антиагрегантной терапии, что демонстрирует следующий клинический случай.
Клинический случай
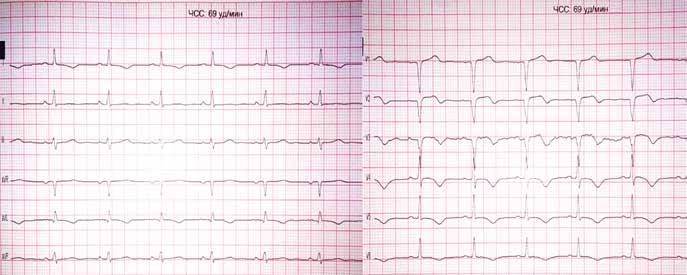
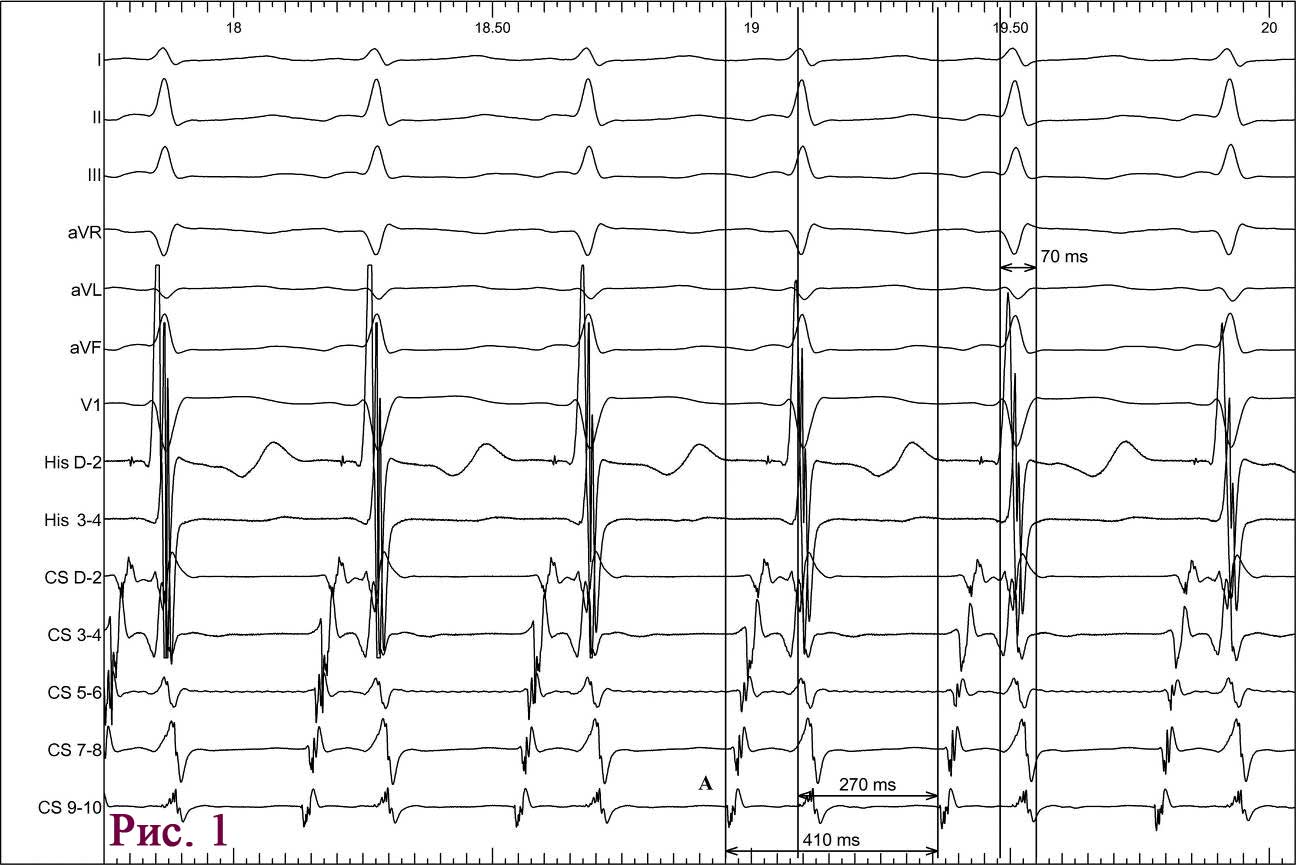
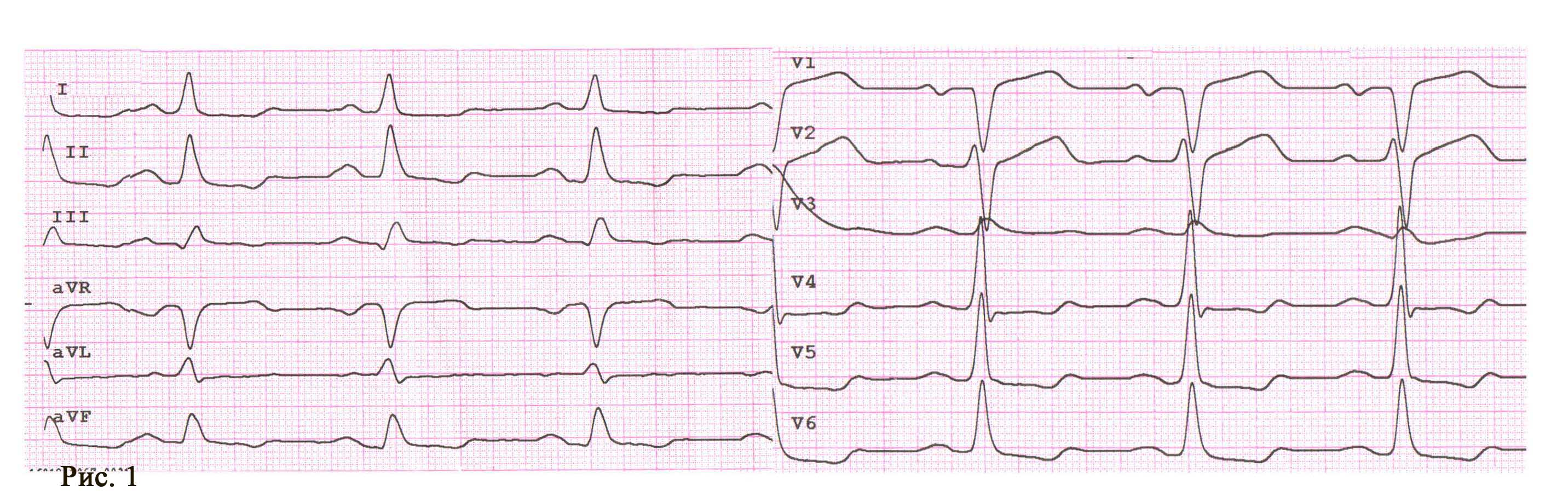
Пациент А., мужчина, 66 лет, поступил в отделение реанимации и интенсивной терапии кардиологического профиля ГУ «ННЦ «Институт кардиологии им. акад. Н. Д. Стражеско» НАМН Украины» с жалобами на появление интенсивных болей за грудиной в покое в течение суток. Длительность максимального болевого приступа в пределах 90 мин. Пациент имеет длительный анамнез ишемический болезни сердца (ИБС), артериальной гипертензии; 5 лет назад перенес ИМ передней локализации без зубца Q. На момент осмотра болевой синдром присутствует после применения наркотических аналгетиков. По результатам электрокардиографии (ЭКГ) диагностирован ОИМ со стойкой элевацией сегмента ST (рис. 1).
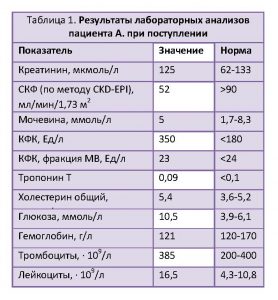
Результаты лабораторных анализов представлены в таблице 1. У пациента повышенный уровень общей креатинфосфокиназы (КФК), пограничные значения МВ-фракции КФК и тропонина, лейкоцитоз, гипергликемия, а также сниженная скорость клубочковой фильтрации (СКФ).
Пациент соответствовал критериям и срокам проведения первичного чрескожного коронарного вмешательства (ЧКВ) для восстановления кровотока в инфаркт-зависимой артерии согласно рекомендациям Европейского общества кардиологов по лечению ОИМ с элевацией сегмента ST [4], поэтому было принято решение готовиться к процедуре. Для начала антитромбоцитарной терапии был выбран тикагрелор, который в дозе 180 мг назначили в комбинации с ацетилсалициловой кислотой (АСК, 300 мг).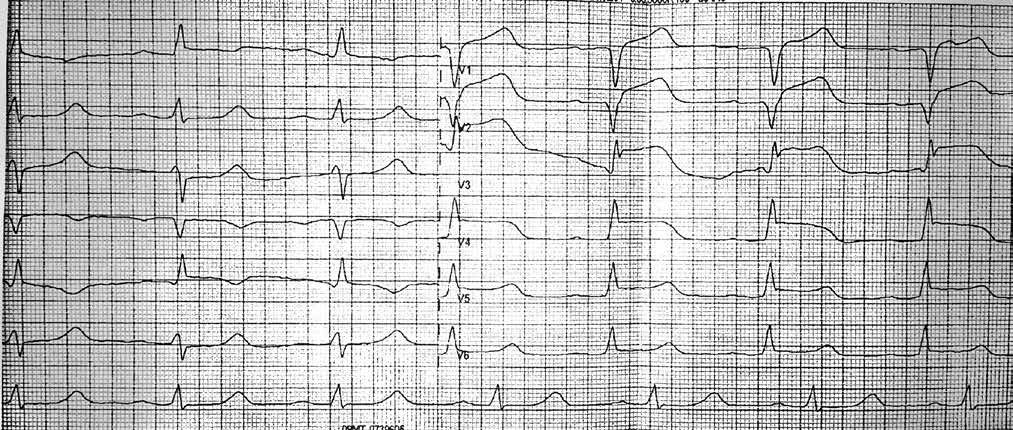
В качестве гиполипидемической терапии назначен аторвастатин в дозе 80 мг. Антикоагулянтная терапия была начата на догоспитальном этапе: больному ввели нефракционированный гепарин внутривенно (в/в). Кроме того, была назначена метаболическая терапия: кверцетин 1,0 г в/в. Для защиты слизистой оболочки желудка от агрессии антиагрегантов и антикоагулянтов в/в введен ингибитор протонной помпы пантопразол в дозе 40 мг. Для обезболивания применяли морфин (1% 1,0 мл в/в).
Комментарий относительно назначения
Аторвастатин в дозе 80 мг, назначенный с первых суток, уменьшал на 16 % частоту больших сердечно-сосудистых событий в первые месяцы после ОКС, по данным исследования MIRACL [6]. Статины рекомендованы всем пациентам с ОКС (без противопоказаний), независимо от уровня липидов крови. Предпочтительна интенсивная статинотерапия (аторвастатин 40-80 мг или розувастатин 20-40 мг). Цель терапии – снижение концентрации холестерина липопротеинов низкой плотности <1,8 ммоль/л [7].
Статины снижают частоту сердечно-сосудистых осложнений и наиболее эффективны при назначении с первых часов ОКС [8]. При ЧКВ статины предупреждают развитие перипроцедурного повреждения миокарда и синдрома невосстановленного кровотока (no-reflow / slow reflow) [9]. Многочисленные исследования показали снижение частоты развития перипроцедурного инфаркта и больших коронарных событий при проведении коронарного вмешательства и использовании нагрузочных доз статинов при острых формах ИБС [10]. Исследователи объясняют это «быстрыми» антитромботическими, стабилизирующими и противовоспалительными эффектами статинов, которые помогают восстановлению тканевого кровотока, защищают миокард от реперфузионного повреждения, предотвращают прогрессирующее тромбообразование и уменьшают частоту перипроцедурных осложнений при перкутанных вмешательствах. Дополнительный аргумент в пользу назначения первой дозы статина перед ЧКВ – данные исследований, в которых такая терапия предупреждала развитие контраст-индуцированной нефропатии [11].
Метаболическая терапия при ОКС не входит в современные рекомендации и клинические протоколы. Однако все больше исследований демонстрируют клиническую пользу фармакологического вмешательства в метаболические пути, опосредующие системный воспалительный ответ, эндотелиальную дисфункцию и электрическую нестабильность миокарда.
Биофлавоноид кверцетин обладает свойствами ингибитора синтеза лейкотриенов, антиоксиданта и модуля тора внутриклеточных реакций синтеза универсального вазодилатирующего фактора оксида азота. Кверцетин дозозависимо стимулирует синтез оксида азота и подавляет синтез провоспалительных цитокинов, чем объясняется его кардиопротективный эффект при ОКС и проведении реперфузионной терапии.
В совместном исследовании ННЦ «Институт кардиологии им. акад. Н. Д. Стражеско» НАМН Украины и Института физиологии им. А. А. Богомольца НАН Украины (А.Н. Пархоменко, В.Е. Досенко, А.А. Сопко и др., 2015) изучалось содержание некодирующих микроРНК в плазме крови, тромбоцитах и моноцитах у пациентов с ОИМ. Эта микроРНК участвует в воспалительном ответе, процессах фиброза и поддержании функции эндотелия. Показано 15-кратное увеличение концентрации микроРНК-155 на фоне применения кверцетина дополнительно к стандартной терапии ИМ с подъемом сегмента ST, что ассоциировалось с меньшей дилатацией левого желудочка и лучшей функцией почек. Еще в одном исследовании, выполненном на базе ННЦ «Институт кардиологии им. акад. Н.Д. Стражеско», показано улучшение результатов теста с эндотелийзависимой дилатацией плечевой артерии, повышение синтеза фактора роста сосудистого эндотелия (VEGF) и снижение уровня миелопероксидазы (маркер выраженной эндотелиальной дисфункции) на 7-й день ИМ с элевацией сегмента ST в результате терапии кверцетином по сравнению с контрольной группой (Я.М. Лутай, А.Н. Пархоменко и др., 2015).
Желудочковые тахикардии с риском трансформации в фибрилляцию желудочков, возникающие в первые часы и дни при ОКС и даже после успешных реперфузионных вмешательств, ассоциируются с высоким риском внезапной смерти и существенно ухудшают прогноз. Установлено, что стойкая мономорфная желудочковая тахикардия в 5 раз реже возникает у пациентов, получающих инфузионную терапию кверцетином в ранние сроки развития ОИМ. Предотвращение формирования аритмогенного субстрата в результате метаболической терапии ассоциировалось с улучшением отдаленного прогноза на протяжении 5 лет наблюдения (А.Н. Пархоменко, С.Н. Кожухов и соавт., 2006). С учетом этих данных кверцетин применяется в составе комплексной терапии ОКС в клинике ННЦ «Институт кардиологии им. акад. Н. Д. Стражеско».
Инвазивное лечение и дальнейшая терапия
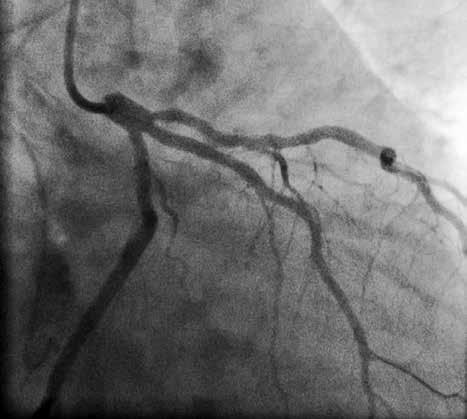
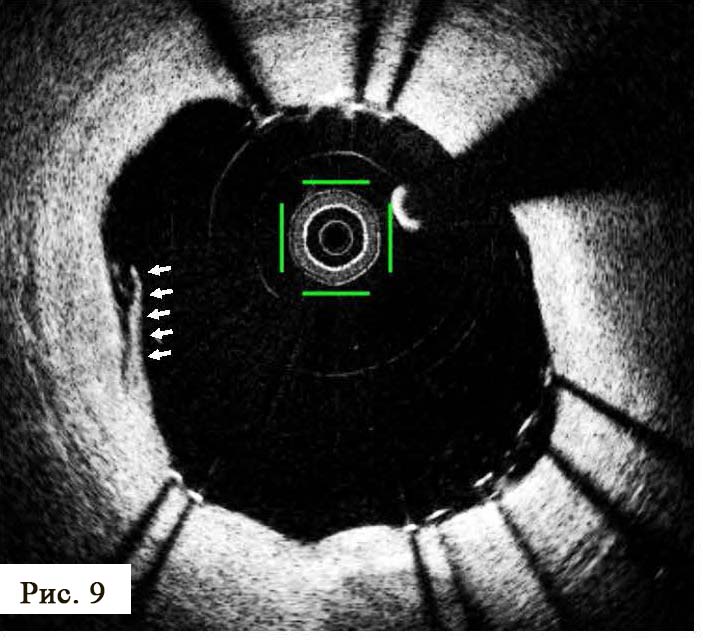
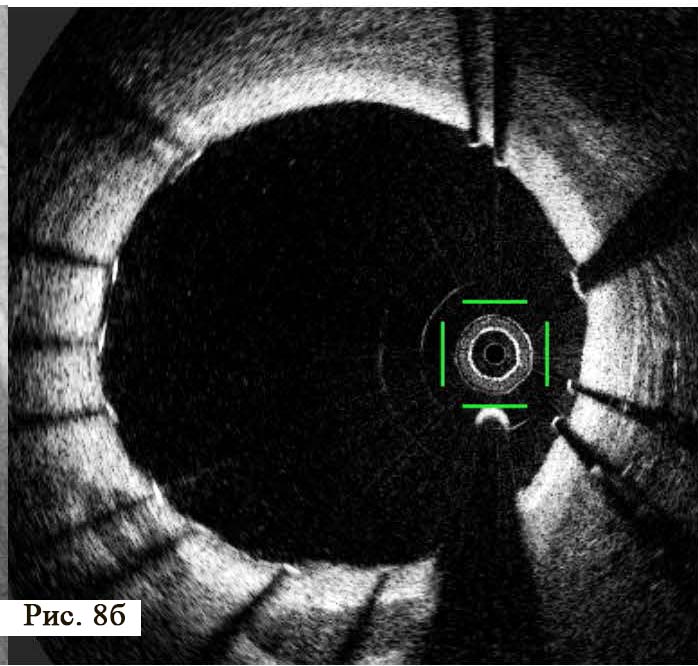
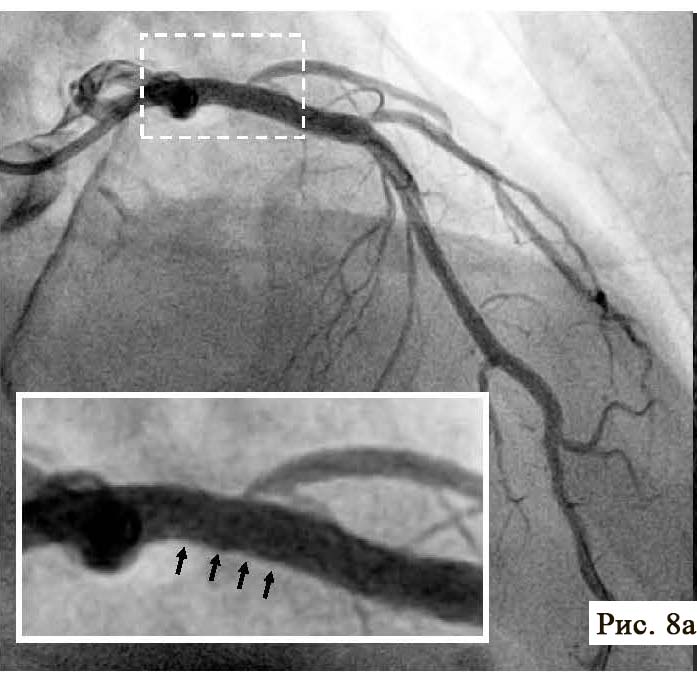
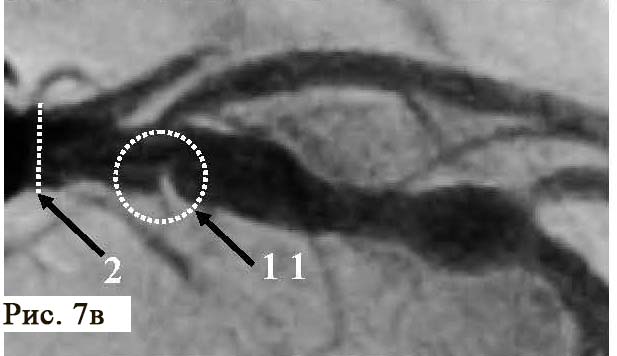
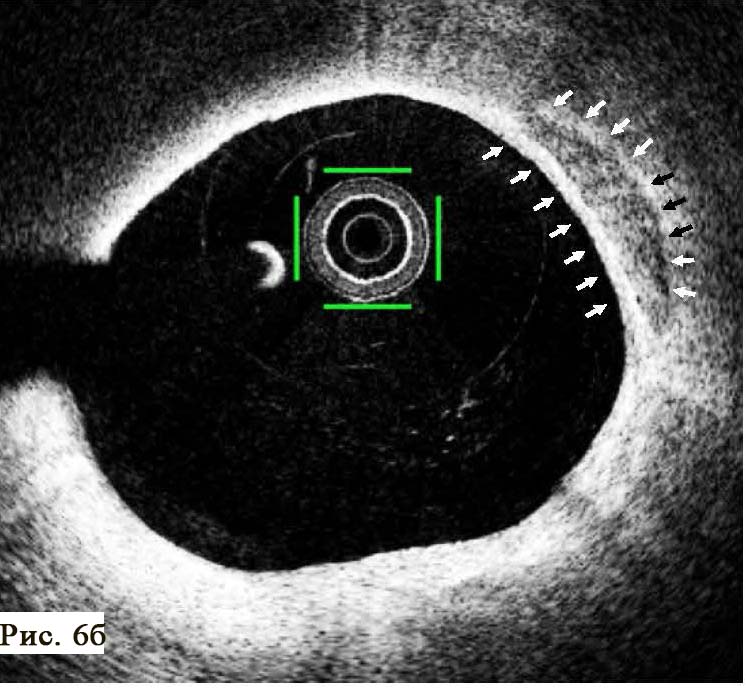
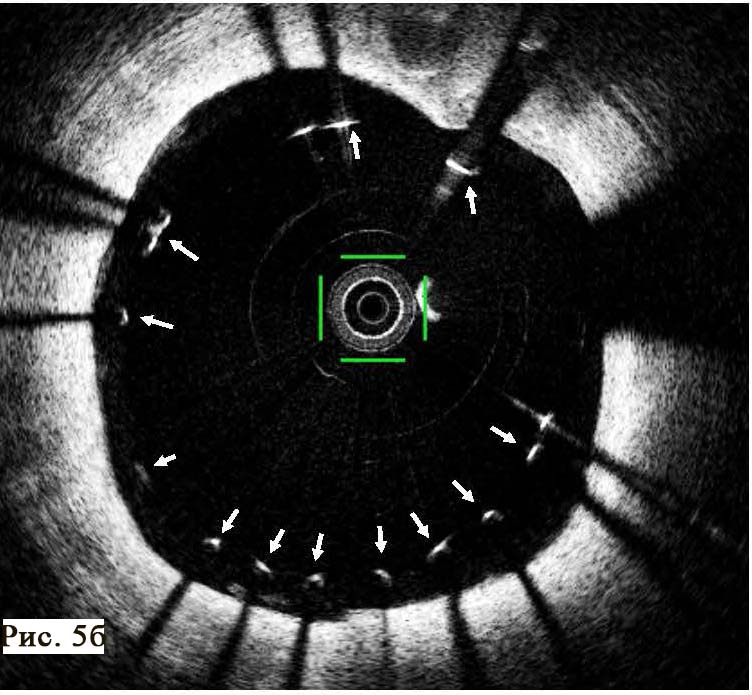
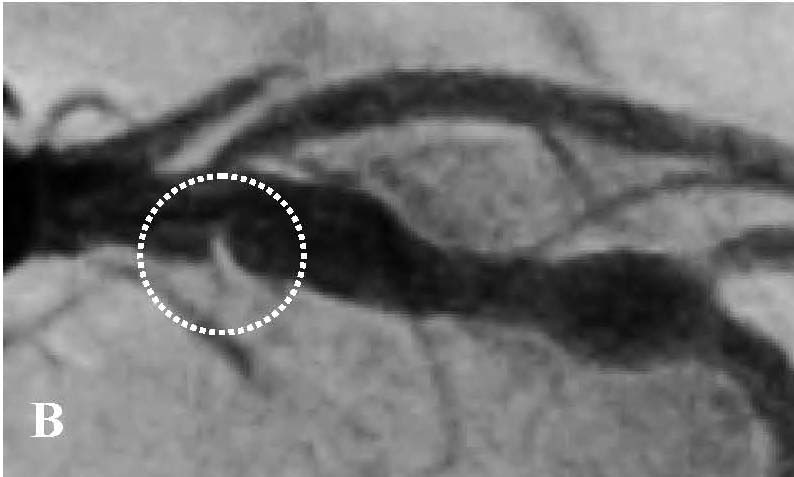
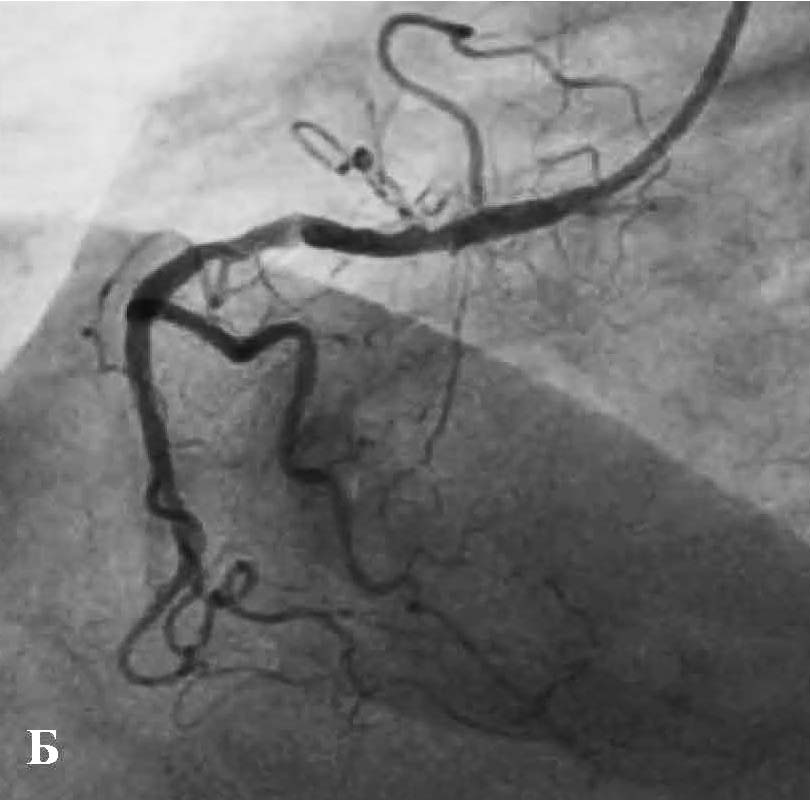
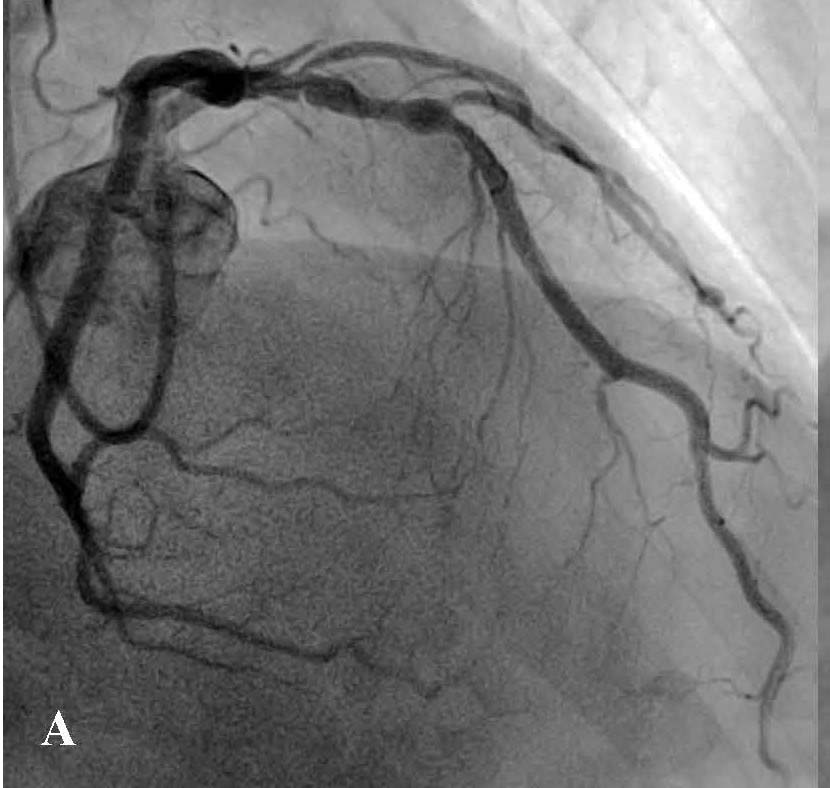
В отделении интервенционной кардиологии ННЦ «Институт кардиологии им. акад. Н. Д. Стражеско» (руководитель – член-корр. НАМН Украины, д. мед. н. Ю.Н. Соколов) пациенту А. была выполнена ургентная коронаровентрикулография (КВГ), которая подтвердила субтотальное поражение инфаркт-зависимой артерии (рис. 2). После проведенной предилатации баллоном в место стенозирования имплантирован BMS (простой металлический стент). После имплантации стента магистральный кровоток TIMI 3, периферический кровоток BG 3 (рис. 3).
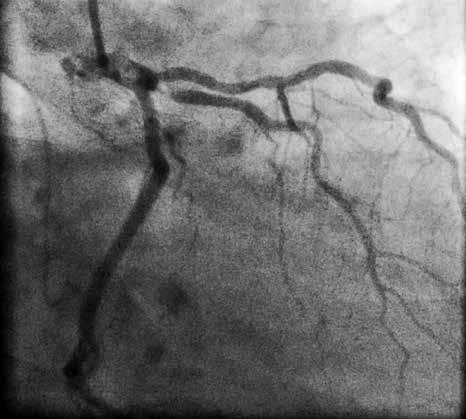
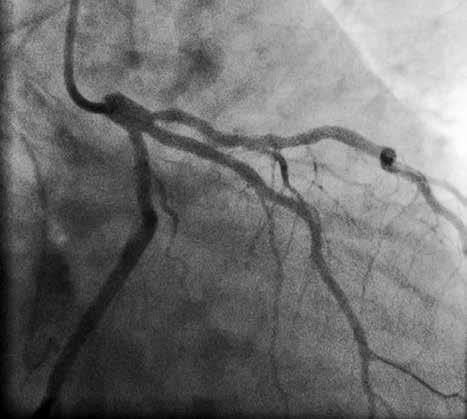
После процедуры продолжена ДАТ: АСК 100 мг/сут + тикагрелор по 90 мг 2 р/сут. Для продолжения антикоагулянтной терапии назначены подкожные инъекции эноксапарина по 1 мг/кг 2 р/сут.
В качестве кардиопротекторной терапии назначены рамиприл по 5 мг 2 р/сут, карведилол по 6,25 мг 2 р/сут, эплеренон 25 мг/сут, продолжены в/в инфузии кверцетина по 0,5 г 2 р/сут. Продлен прием аторвастатина по 80 мг/сут.
Комментарий относительно выбора препаратов кардиопротекторной терапии
Основу защиты сердца от постинфарктного ремоделирования составляют традиционные нейрогуморальные антагонисты – бета-блокаторы и ингибиторы ангиотензинпревращающего фермента (АПФ). Их положительное влияние на прогноз пациентов, перенесших ОИМ, не вызывает сомнений в связи с убедительными результатами серии исследований, проведенных в 1990-х годах.
Вместе с тем только два ингибитора АПФ – рамиприл и периндоприл – имеют доказательства уменьшения сердечно-сосудистых событий у данной категории больных. В международном многоцентровом исследовании AIRE терапия рамиприлом в дозе 5 мг 2 р/сут назначалась 1014 пациентам с 3-10-го дня после перенесенного ИМ с признаками сердечной недостаточности. За период наблюдения в среднем 15 мес рамиприл дополнительно к оптимальной терапии ИМ по сравнению с плацебо достоверно снижал на 27 % общую смертность в этой группе больных [12]. После завершения исследования 603 пациента включили в продленную фазу наблюдения длительностью 42-59 мес (AIREX), в ходе которой они продолжали принимать рамиприл в прежней дозе. И снова было получено достоверное снижение смертности от всех причин – на 36 % к пятому году наблюдения [13]. Таким образом, раннее назначение рамиприла пациентам с ОИМ ассоциируется с лучшей выживаемостью в ближайшие годы.
Есть основания считать, что этот эффект не является общим для всего класса ингибиторов АПФ. Канадское ретроспективное исследование, в котором анализировали выживаемость больных старше 65 лет после ИМ (n=7512), получавших назначения разных ингибиторов АПФ, показало отчетливые преимущества рамиприла перед большинством представителей класса в первые 12 мес [14].
Последняя ветвь эволюции фармакотерапии ИМ – применение антагонистов минералокортикоидных рецепторов, к которым согласно современной классификации относятся спиронолактон, эплеренон и канренон. Наиболее убедительной доказательной базой в лечении постинфарктных больных обладает эплеренон (исследование EPHESUS [15]).
Фибрилляция предсердий – повод пересмотреть терапию
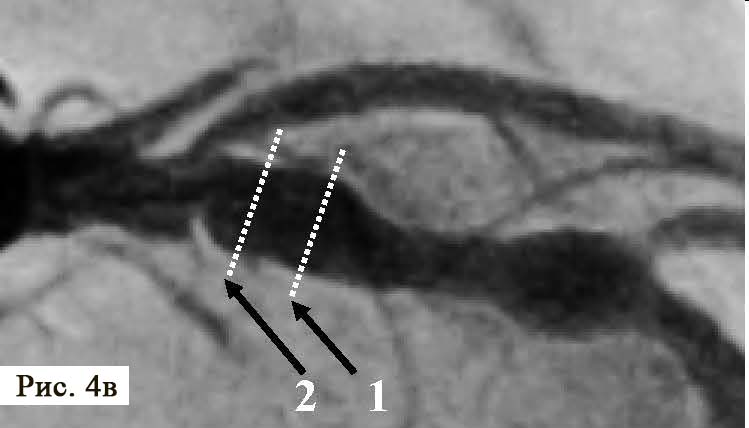
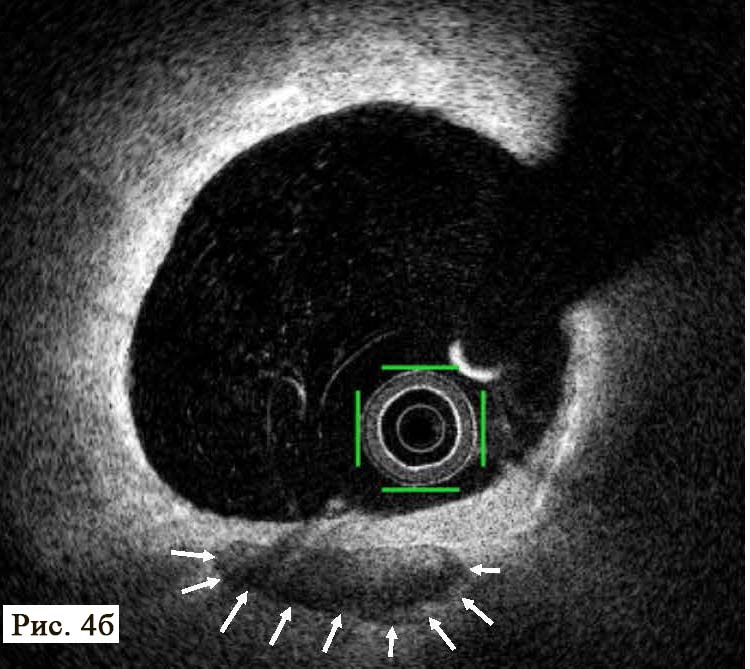
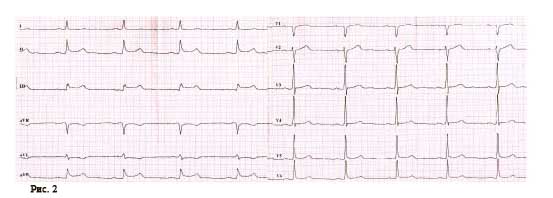
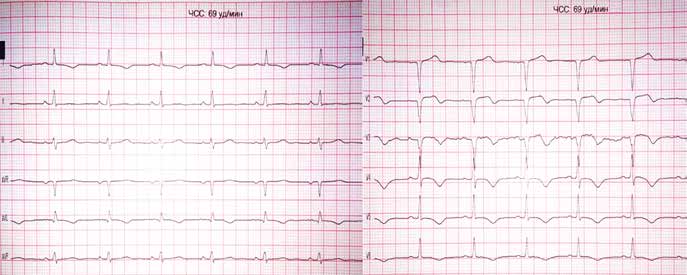
Через 18 ч после проведения КВГ и стентирования на фоне удовлетворительного самочувствия пациента, без болевого синдрома при адекватной гемодинамике на ЭКГ зафиксирован пароксизм ФП (рис. 4).
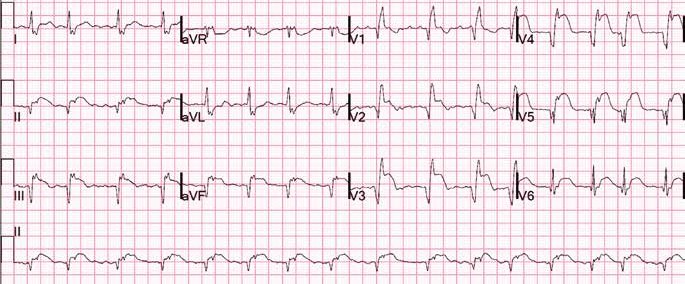
Появление этой аритмии, несмотря на то что ФП напрямую не угрожает жизни, заставляет пересмотреть тактику ведения пациента. Перед врачом в этом случае стоят три вопроса:
– Как реагировать на нарушение ритма?
– Что делать с продолжающейся антикоагулянтной терапией?
– Что делать с продолжающейся антитромбоцитарной терапией?
Ответ на первый вопрос находим в европейских рекомендациях по лечению ОИМ с элевацией сегмента ST [4]. Если ФП возникает на фоне ОКС, ургентная электрическая кардиоверсия (восстановление синусового ритма) рекомендована в первую очередь пациентам с нестабильной гемодинамикой. Электрическая кардиоверсия или фармакологическая кардиоверсия амиодароном рекомендована пациентам, когда необходимо восстановить синусовый ритм не ургентно (стратегия контроля ритма). Эта стратегия может применяться у пациентов с впервые возникшим эпизодом ФП продолжительностью <48 ч.
Принимая во внимание четко зафиксированное начало пароксизма аритмии, было принято решение провести фармакологическую кардиоверсию в/в введением амиодарона. В соответствии с Унифицированным клиническим протоколом по ведению пациентов с ОКС с элевацией сегмента ST (Приказ МЗ Украины № 455 от 02.07.2014) амиодарон для восстановления синусового ритма у пациентов с недавно начавшейся ФП применяется путем в/в инфузии в нагрузочной дозе 5 мг/кг массы тела пациента длительностью от 20 мин до 2 ч. Введение можно повторять 2-3 раза в течение 24 ч, корректируя скорость инфузии в соответствии с результатами и переносимостью.
На фоне вышеописанной антиаритмической терапии у пациента отмечается восстановление синусового ритма. Учитывая нестабильность ритма, продлена терапия амиодароном в пероральном режиме.
Антикоагулянтная терапия
ФП ассоциируется с повышенным риском кардиоэмболического инсульта, и этот риск сохраняется, даже если пароксизм аритмии был прерван и пациент выписывается из стационара с синусовым ритмом [1]. В связи с этим пациенты с ФП и наличием других факторов тромбоэмболизма должны получать пероральную антикоагулянтную терапию. Критерием ее назначения служит оценка по шкале CHA2DS2-VASc. По ней наш пациент набирает 3 балла, что соответствует годовому риску тромбоэмболических событий 5,92 % (табл. 2). Согласно Европейским рекомендациям по ведению пациентов с ФП [16] оценка по CHA2DS2-VASc ≥2 балла является однозначным показанием к назначению перорального антикоагулянта.
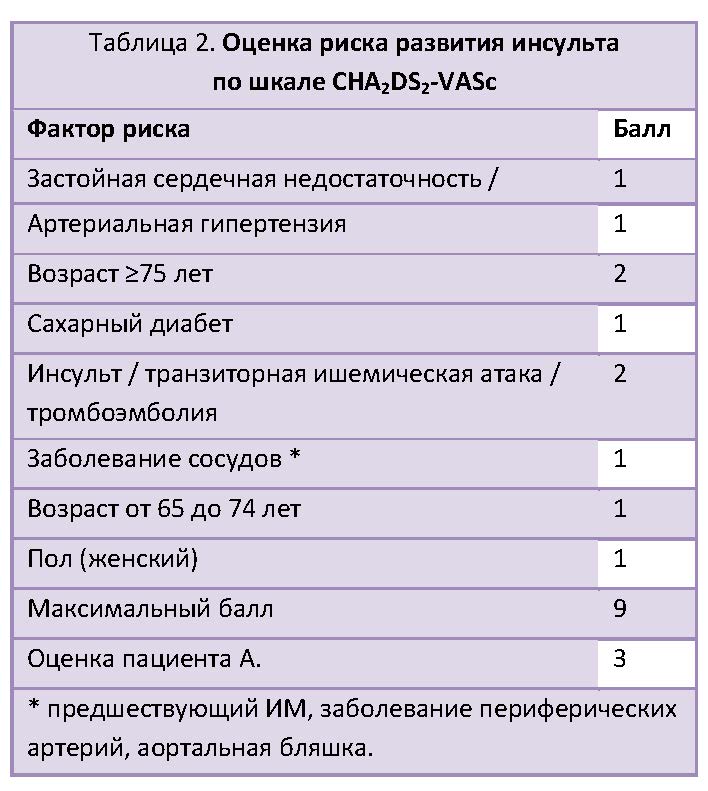
С другой стороны, после ЧКВ пациент должен продолжать прием двойной антиагрегантной терапии. Кроме того, он получает подкожные инъекции эноксапарина. В соответствии с европейскими рекомендациями по реваскуляризации миокарда [7] у пациентов с показаниями к назначению таблетированных антикоагулянтов (в том числе при ФП с оценкой по CHA2DS2-VASc ≥2, с венозной тромбоэмболией, тромбом в полостях сердца или искусственным клапаном) они рекомендованы дополнительно к антиагрегантной терапии. Переход к пероральной антикоагулянтной терапии происходит при возможности отмены парентеральных антикоагулянтов. При на значении антагонистов витамина К (АВК) отмена парентеральных антикоагулянтов происходит при достижении международного нормализованного отношения (МНО) 2,0-2,5, то есть инъекции антикоагулянта некоторое время необходимо продолжать, пока не будет подобрана адекватная доза АВК (например, варфарина). Новые (или прямые) оральные антикоагулянты (НОАК) можно назначать сразу после отмены парентеральных антикоагулянтов, вместо следующей инъекции.
Европейский консенсус ESC/EHRA/EAPCI [17] рассматривает вопросы сочетания антикоагулянтной и антиагрегантной терапии у пациентов с неклапанной ФП, у которых развивается ОКС или выполняется ЧКВ на коронарных артериях. В таких случаях эксперты предписывают тройную терапию (пероральный антикоагулянт + клопидогрель 75 мг/сут + АСК 75-100 мг/сут) и регламентирует ее сроки. У пациентов с ОКС и ФП с низким риском кровотечения (например, оценка по шкале HAS-BLED ≤2), тройная терапия должна продолжаться в течение 6 мес независимо от типа имплантированного стента, в дальнейшем рекомендуется переход на двойную терапию: пероральный антикоагулянт + АСК или клопидогрель на протяжении 12 мес. У пациентов с показаниями к назначению таблетированных антикоагулянтов и высоким риском кровотечения (HAS-BLED ≥3) тройная терапия должна продолжаться в течение 1 мес, в последующем рекомендован переход на пероральный антикоагулянт в комбинации с АСК или клопидогрелем. Напомним, что после ЧКВ пациент А. получает двойную антиагрегантную терапию АСК и тикагрелором, которая однозначно показана для профилактики тромбоза стента и повторного ИМ. Пероральный антикоагулянт ему также показан для профилактики кардиоэмболического инсульта. Рекомендованные схемы тройной терапии в качестве антиагрегантов включают только АСК и клопидогрель. Использование тикагрелора и прасугреля как компонентов тройной терапии не рекомендуется.
Эффекты тройной антитромботической терапии изучали в исследовании PIONEER AF-PCI [18] с участием пациентов с ФП, которым выполняли ЧКВ. Пациентам назначали двойную терапию НОАК (ривароксабан 15 мг/сут) и одним из ингибиторов P2Y12 (клопидогрель, тикагрелор, прасугрель) или тройную терапию с очень низкой дозой НОАК (ривароксабан 2,5 мг/сут + АСК + P2Y12-ингибитор). Эти две схемы сравнивали с комбинацией варфарина (с поддержанием целевого МНО 2,0-3,0) и ДАТ на протяжении 1, 6 или 12 мес. У подавляющего большинства пациентов в этом исследовании применялся клопидогрель, а тикагрелор принимали лишь 4% больных. Ввиду этого тройная терапия с клопидогрелем считается наиболее изученной.
Кроме того, результаты исследования PIONEER AF-PCI, а еще раньше – исследования WOEST поставили под сомнение целесообразность тройной терапии с двумя антиагрегантами. В исследовании WOEST сравнивались результаты двойной (варфарин + клопидогрель) и тройной терапии (варфарин + клопидогрель + АСК) у пациентов, которым выполняли стентирование коронарных артерий (ФП была у 69% участников). Частота кровотечений на тройной терапии закономерно увеличилась по сравнению с двойной терапией. При этом варфарин и клопидогрель без АСК столь же эффективно предотвращали тромбозы, как и тройная терапия [19].
Метаанализ 15 исследований, включивший данные 7182 больных, показал, что двойная терапия более безопасна, чем тройная, у пациентов с ФП после ЧКВ. Терапия пероральный антикоагулянт + клопидогрель ассоциировалась со снижением количества кровотечений и снижением частоты смерти, ИМ, инсульта, реваскуляризации и тромбоза стента по сравнению с тройной терапией [20].
Клопидогрель – антиагрегант, обладающий широкой доказательной базой в лечении пациентов с ОКС. В соответствии с современными рекомендациями клопидогрель может быть назначен при ОКС с элевацией и без элевации сегмента ST при любой стратегии лечения.
С учетом вышеописанных данных было принято решение перевести пациента с приема тикагрелора на клопидогрель и отменить АСК как второй компонент антиагрегантной терапии.
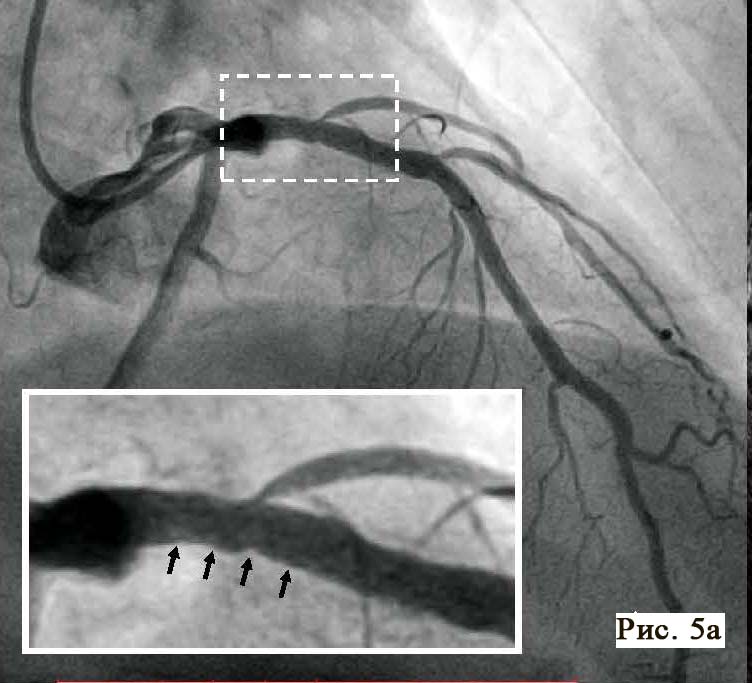
В результате пациент в стабильном состоянии оставлен на антитромботической терапии клопидогрелем (75 мг/сут), дополнительно назначена пероральная антикоагулянтная терапия (рис. 5).
Продлена кардиопротекторная и прогнозмодифицирующая терапия рамиприлом, карведилолом, эплереноном, триметазидином MR, а также высокодозовая гиполипидемическая терапия (аторвастатин 80 мг, пожизненно).