О.С. Стичинський, А.В. Якушев, О.З. Парацій, Р.Г. Малярчук, Б.Б. Кравчук, В.Ф. Оніщенко
Пароксизмальні суправентрикулярні тахікардії (СВТ) є доброякісними порушеннями ритму серця. Разом з тим вони часто стають причиною значного погіршення якості життя пацієнтів [16]. Найпоширенішими СВТ, які реалізуються за механізмом re-entry, є атріовентрикулярна (АВ) реципрокна тахікардія (АВРТ) та АВ-вузлова реципрокна тахікардія (АВВРТ). Частота виникнення АВВРТ та АВРТ становить відповідно 5 та 2–4 випадки на 1000 населення. Основним субстратом для АВВРТ є наявність подвійних АВ-вузлових шляхів, що було запропоновано Denes та співавторами ще в 1973 р. Проте незважаючи на численні дослідження, механізм АВВРТ досі залишається до кінця невивченим, оскільки за наявності подвійної фізіології АВ-вузла у 20–30 % осіб, АВВРТ розвивається лише в 3 % випадків [11, 13]. Проведення електричного збудження по додатковому шляху проведення (ДШП) є результатом неповного ембріологічного диференціювання фіброзних кілець між передсердями і шлуночками та є субстратом для виникнення АВРТ (синдром Вольфа – Паркінсона – Уайта (Wolff – Parkinson – White, WPW)) або безсимптомної преекзитації (феномен WPW) [14]. Враховуючи відносну рідкість цих захворювань, комбінація цих двох патологій взагалі казуїстична. Екзотичне поєднання породжує обмеження досвіду серед кардіологів у проведенні диференційної діагностики, визначенні субстрату аритмії, що потенційно може погіршувати результати лікування і водночас збільшувати ризик ускладнень.
Метою роботи був аналіз рідкісного клінічного випадку атипової АВВРТ з наявністю кількох варіантів суправентрикулярних тахікардій у одного пацієнта. Робота ґрунтується на аналізі клінічного перебігу АВВРТ із супутнім феноменом WPW та результатах його лікування у пацієнта на базі клініки ДУ «Національний інститут серцево-судинної хірургії ім. М.М. Амосова» НАМН України (НІССХ). Доопераційне обстеження хворого передбачало проведення електрокардіографії (ЕКГ) та ехокардіографії (ЕхоКГ) за стандартними методиками. Електрофізіологічне дослідження (ЕФД) та радіочастотну абляцію (РЧА) проводили за допомогою електрофізіологічної системи Bard Electrophysiology з використанням радіочастотного генератора IBI-1500Т11 (St. Jude Medical), декаполярного некерованого електрода Response (St. Jude Medical) та квадриполярного керованого абляційного електрода Therapy 4 mm (St. Jude Medical). Рентгенографічну та рентгеноскопічну навігацію здійснювали за допомогою ангіографа Toshiba Infinix CC-i. ЕФД проводили за стандартними протоколами, використовуючи пункційний хірургічний доступ до правої внутрішньої яремної вени та правої стегнової вени.
Клінічний випадок
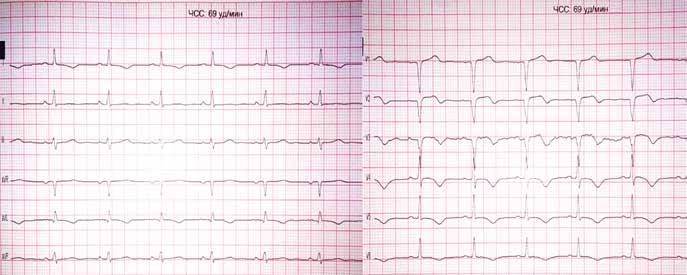
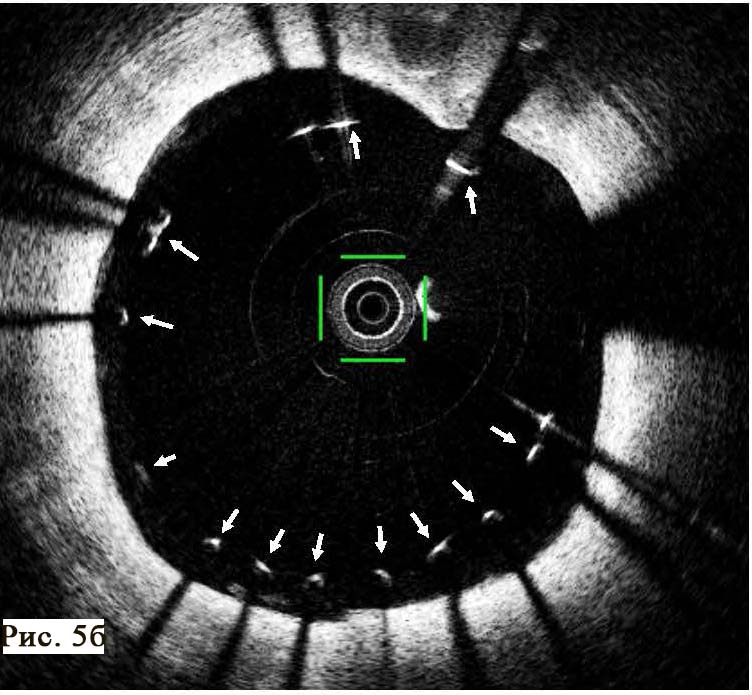
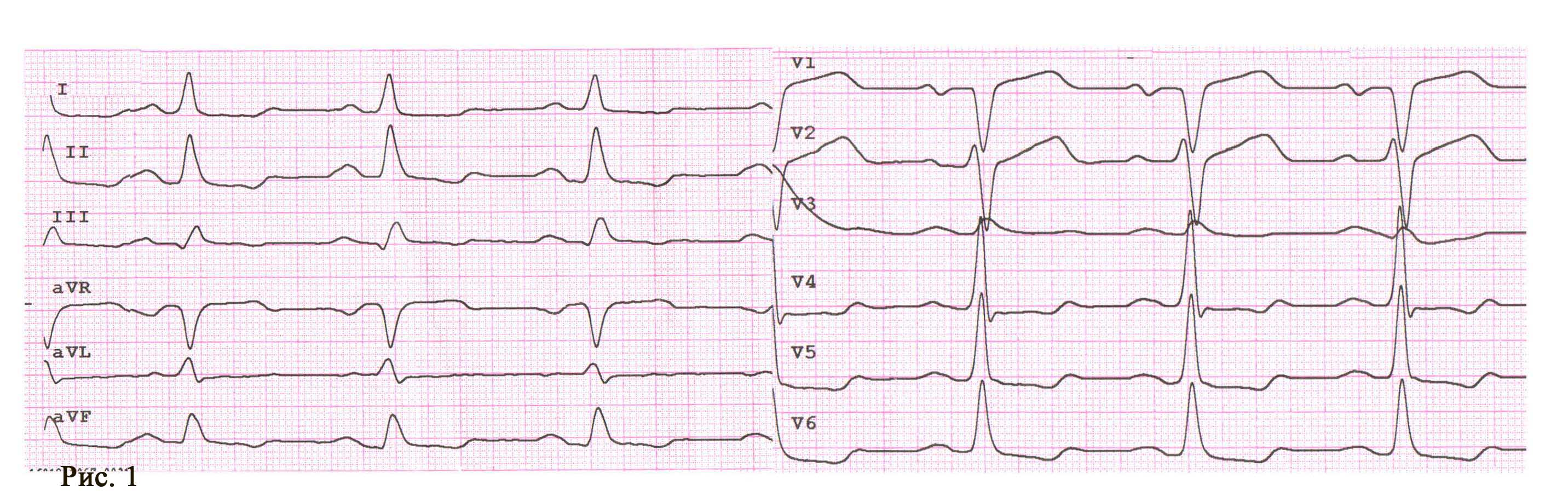
Пацієнт І., 16 років, чоловічої статі, госпіталізований у НІССХ зі скаргами на напади раптового серцебиття та запаморочення під час них. За даними ЕхоКГ структура серця була без патологічних змін. На ЕКГ виявлено типові ознаки WPW: хвилі дельта, вкорочений інтервал PR (80 мс) та розширений комплекс QRS (130 мс). Електрична вісь хвилі дельта, за даними ЕКГ, відповідала передній – передньо-септальній локалізації ДШП. Під час ЕФД програмованою передсердною стимуляцією було спровоковано СВТ із кардіоциклом 410 мс, вузьким комплексом QRS (70 мс) та найранішою точкою активації в гирлі коронарного синуса (рис. 1). Інтервал VH становив 340 мс (RP – 270 мс).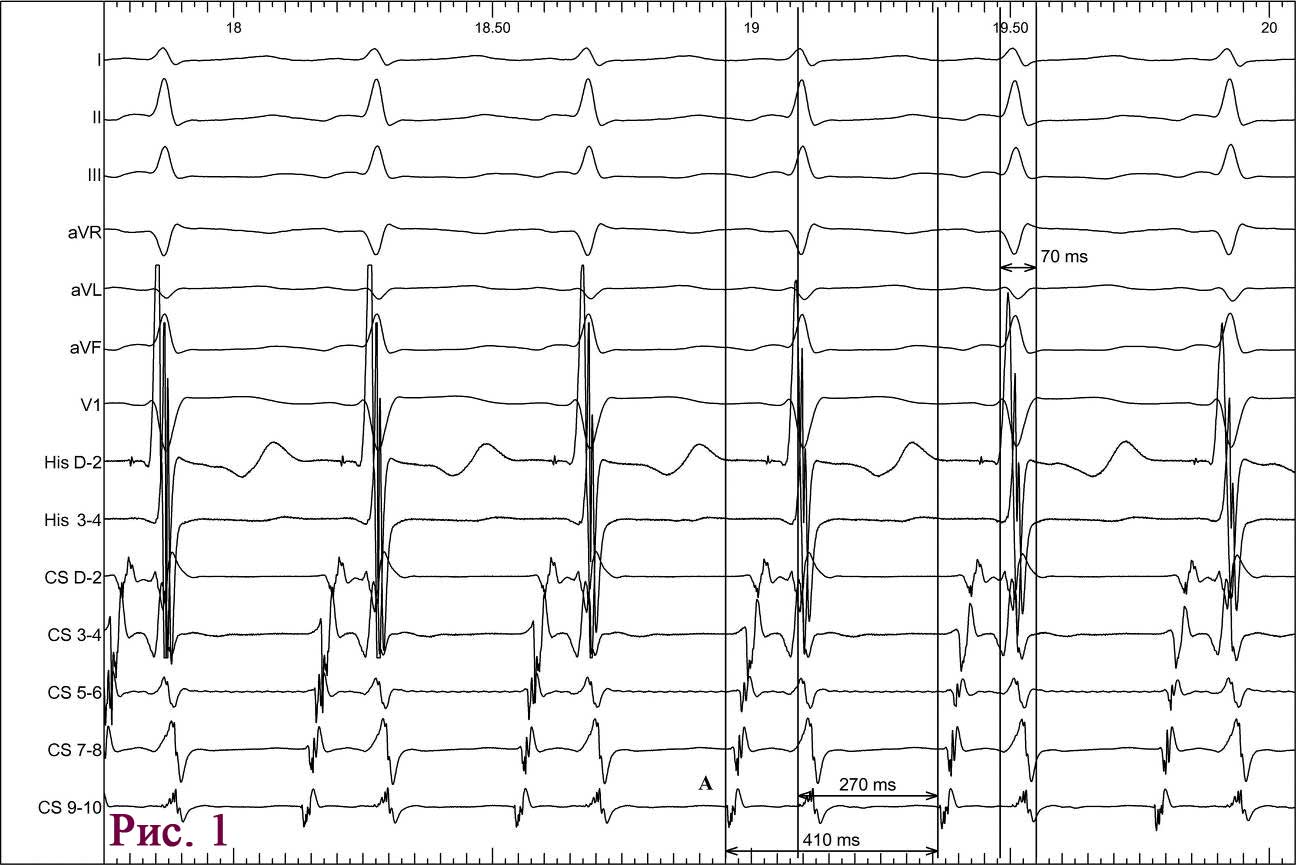
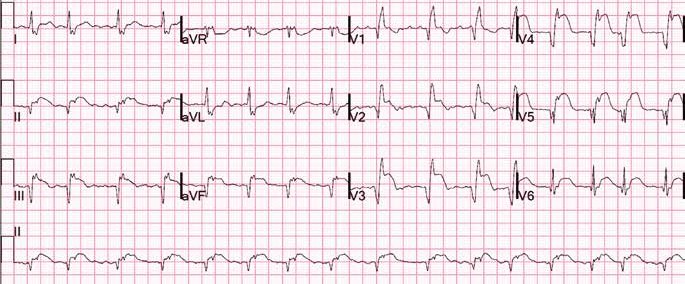
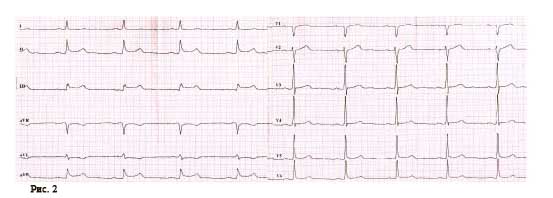
Під час епізоду відбулася трансформація морфології комплексів QRS – зареєстровано дельта-хвилю, яка випереджала електрограму пучка Гіса на 28 мс, комплекс QRS становив 130 мс, проте значущої зміни кардіоциклу не зареєстровано; інтервал VH становив 330 мс (RP – 260 мс) (рис. 2).
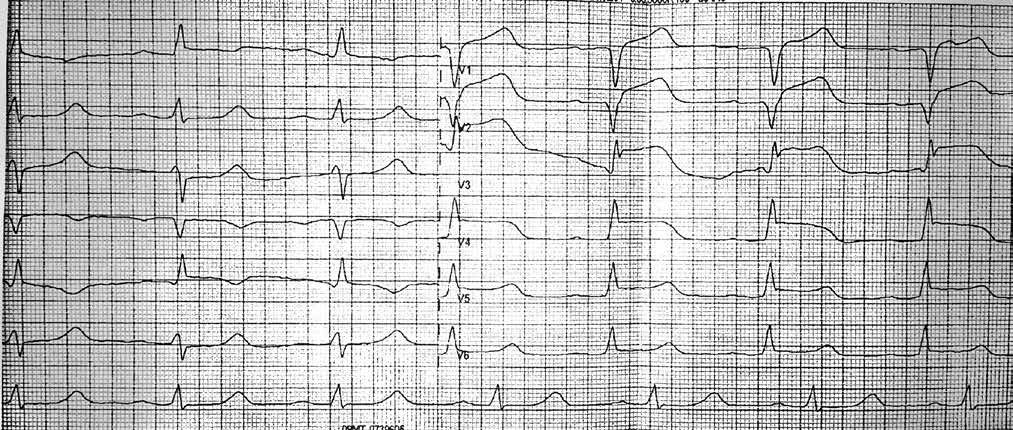
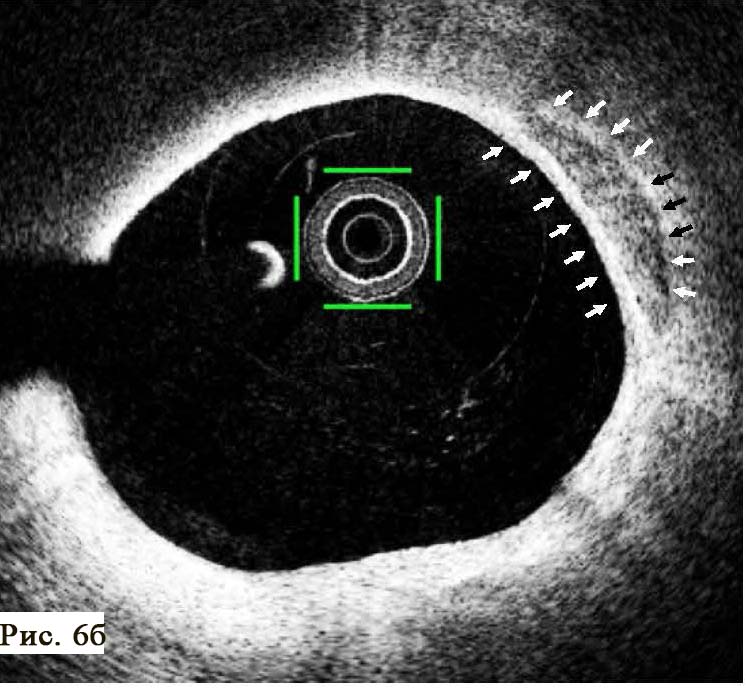
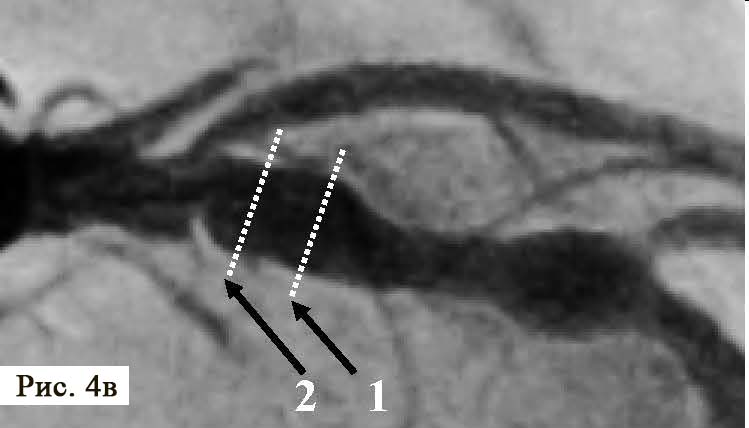
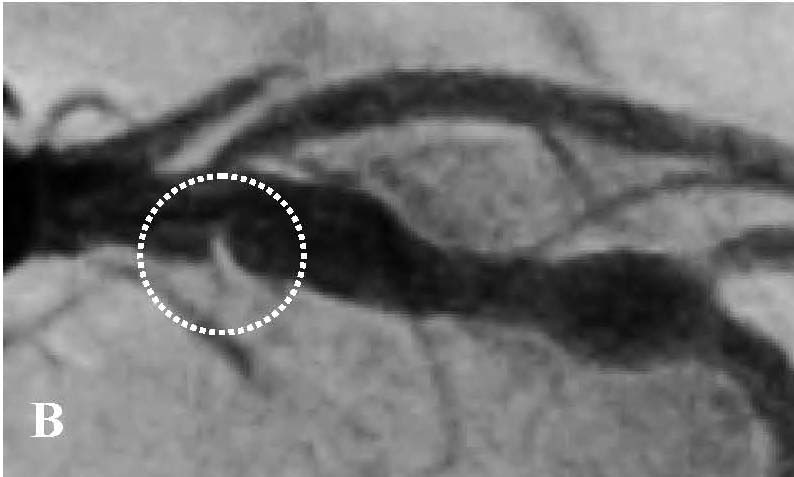
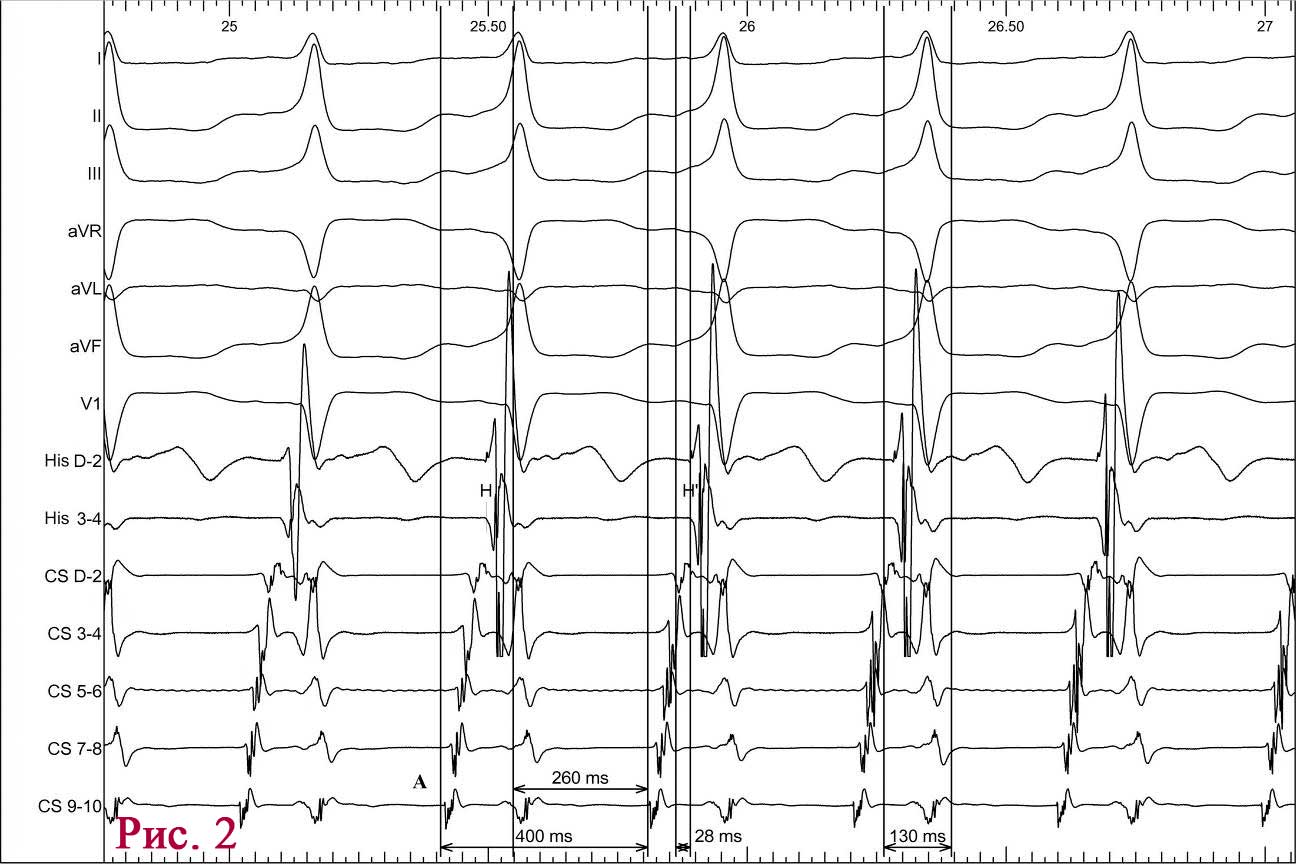 При подальшому дослідженні виявлено періодичну появу дельта-хвилі, що не впливала на зміну кардіоциклу та послідовність електричної активації лівого передсердя. Зміна кардіоциклу була обумовлена зміною інтервалу АН та зміною точки виходу електричного збудження на міокард передсердь (рис. 3) – з проекції гирла коронарного синуса на проекцію зв’язки Тодаро за даними рентгеноскопії. Вищезазначене могло свідчити про наявність АВВРТ із почерговим залученням двох повільних шляхів, що проводили електричне збудження ретроградно на тканину передсердь та мали відмінні точки виходу (час ретроградного проведення 280 мс та 230 мс відповідно). Для підтвердження діагнозу АВВРТ було проведено стимуляційні маневри (Гіс-синхронізована стимуляція), які показали (не зареєстровано «ресет» феномена під час стимуляції шлуночків у момент рефрактерності пучка Гіса), що міокард шлуночків не є необхідною складовою для підтримання тахікардії, що свідчило проти діагнозу АВРТ. Різниця інтервалів АН під час передсердної стимуляції та тахікардії становила 50 мс (120 та 70 мс відповідно), що з великою вірогідністю заперечувало передсердну тахікардію [10]. З верхівки правого шлуночка проведено успішний ентреймент тахікардії з періодом стимуляції 370 мс: постстимуляційний інтервал (ПСІ) становив 550 мс, коректована (за АН) різниця ПСІ та кардіоциклу тахікардії [7] була 140 мс, що на думку багатьох дослідників [10] є чутливим і специфічним критерієм діагностики АВВРТ.
При подальшому дослідженні виявлено періодичну появу дельта-хвилі, що не впливала на зміну кардіоциклу та послідовність електричної активації лівого передсердя. Зміна кардіоциклу була обумовлена зміною інтервалу АН та зміною точки виходу електричного збудження на міокард передсердь (рис. 3) – з проекції гирла коронарного синуса на проекцію зв’язки Тодаро за даними рентгеноскопії. Вищезазначене могло свідчити про наявність АВВРТ із почерговим залученням двох повільних шляхів, що проводили електричне збудження ретроградно на тканину передсердь та мали відмінні точки виходу (час ретроградного проведення 280 мс та 230 мс відповідно). Для підтвердження діагнозу АВВРТ було проведено стимуляційні маневри (Гіс-синхронізована стимуляція), які показали (не зареєстровано «ресет» феномена під час стимуляції шлуночків у момент рефрактерності пучка Гіса), що міокард шлуночків не є необхідною складовою для підтримання тахікардії, що свідчило проти діагнозу АВРТ. Різниця інтервалів АН під час передсердної стимуляції та тахікардії становила 50 мс (120 та 70 мс відповідно), що з великою вірогідністю заперечувало передсердну тахікардію [10]. З верхівки правого шлуночка проведено успішний ентреймент тахікардії з періодом стимуляції 370 мс: постстимуляційний інтервал (ПСІ) становив 550 мс, коректована (за АН) різниця ПСІ та кардіоциклу тахікардії [7] була 140 мс, що на думку багатьох дослідників [10] є чутливим і специфічним критерієм діагностики АВВРТ.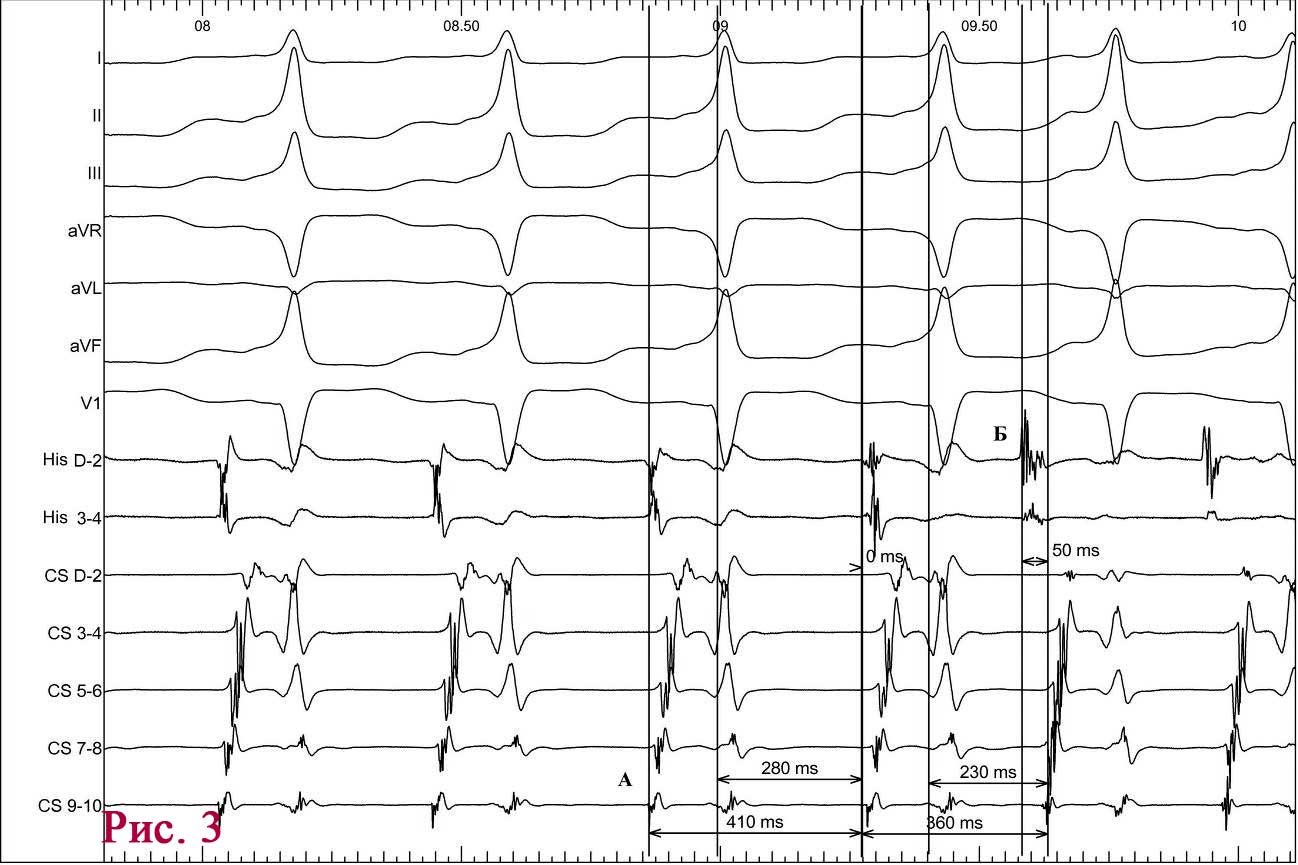
Під час проведення стимуляційних маневрів та оцінювання даних активаційного картування в ході ЕФД встановлено, що ДШП має передню локалізацію і участі в колі re-entry тахікардії не бере.
Таким чином, встановлено діагноз: атипова АВВРТ (варіант fast-slow) із залученням двох повільних шляхів проведення електричного збудження у ретроградному напрямку; феномен WPW. У зоні виходу повільних шляхів було нанесено 4 радіочастотні аплікації з потужністю 35 Вт та середнім часом аплікації (40±5) с. При контрольному ЕФД через 30 хв після останньої аплікації АВВРТ та ехо-комплекси не провокувалися. З метою стратифікації ризику раптової серцевої смерті проведено електрофізіологічну оцінку ДШП. Ефективний рефрактерний період ДШП становив 350 мс. Враховуючи низький ризик раптової серцевої смерті та незалучення ДШП у колі re-entry СВТ, РЧА ДШП не проводили.
При контрольному обстеженні через 6 міс пацієнт відзначав суттєве поліпшення якості життя, пов’язане з відсутністю нападів серцебиття. За результатами контрольного холтерівського моніторування ЕКГ пароксизмів СВТ не виявлено.
Обговорення
На сьогодні основною лікувальною тактикою для пацієнтів з ДШП та АВВРТ є РЧА [1, 3, 4]. За даними попередніх досліджень, ефективність РЧА при АВВРТ становить близько 98 % при частоті значних ускладнень (в основному АВ-блокади різних ступенів) приблизно 1,4 %. Частота рецидивів АВВРТ дорівнює 1,5 % у термін спостереження понад 60 міс [6]. Середня ефективність РЧА при АВРТ – близько 97 %, хоча її ефективність суттєво залежить від локалізації ДШП. Частоту серйозних ускладнень при РЧА ДШП оцінюють менше 1 %, а частоту рецидивів АВРТ – як 18 % [5, 9]. Окрему групу становлять пацієнти з рідкісним поєднанням субстратів кількох СВТ. Складність хірургічної тактики в цієї групи пацієнтів полягає у правильному встановленні електрофізіологічного механізму СВТ, що підвищує успішність РЧА та зменшує кількість неефективних радіочастотних аплікацій [8, 15].
Таким чином, накопичений досвід показує, що РЧА є безпечним, ефективним та радикальним підходом при АВРТ та АВВРТ [2]. Проте слід зазначити, що успішне відтворення зазначених результатів провідних клінік можливе лише в спеціалізованих центрах, де фахівці мають достатній досвід діагностики та лікування складних тахіаритмій [9].
Представлений випадок рідкісного поєднання субстратів кількох різних СВТ у одного пацієнта свідчить про необхідність поглибленого та ретельного обстеження цієї категорії пацієнтів.
Висновки
На цей момент єдиною радикальною можливістю позбутися АВРТ та АВВРТ є РЧА з очікуваною ефективністю 90–95 % та низьким ризиком ускладнень. Незважаючи на наявність загальноприйнятих методів РЧА при АВВРТ та АВРТ і можливостей доопераційного визначення локалізації ДШП за даними ЕКГ, у деяких випадках диференційний діагноз та вибір субстрату для РЧА залишається досить складним, особливо при поєднанні кількох СВТ у одного пацієнта. Представлений клінічний досвід демонструє можливість незалучення ДШП у колі re-entry тахікардії, яке при стандартному обстеженні може «маскувати» справжній механізм виникнення СВТ та бути хибним субстратом для РЧА. Коректна інтерпретація даних внутрішньосерцевого ЕФД та досвід у проведенні РЧА дозволяє точно встановити електрофізіологічний механізм СВТ і відповідно суттєво підвищити ефективність нанесення радіочастотних аплікацій та знизити ризик можливих ускладнень для пацієнта.